Sarkoidozda Standart Tedavi
Sarkoidozda klinik tablo ve hastalığın progresyonu değişkenlik göstermektedir. Evre I hastaların %55-90’ında, evre II hastaların %40-70’inde ve evre III hastaların da %10-20’sinde spontan rezolüsyon görülmektedir. Bu nedenle, hastalığın başlangıçtaki değerlendirilmesi ve tedavi başlama kararının verilmesi ve hangi tedavinin uygulanacağı çok önemlidir. Bazı hastalara hiçbir tedavi verilmediği halde bazı hastalarda ise biyolojik ajanlar ve sitotoksik ajanlar dâhil olmak üzere birçok farklı tedavi kullanılmaktadır.
Akut hastalık; Tanıdan sonra 2-5 yıl içinde iyileşen tablodur.[1] Rezidüel defekt, fibrozis, enflamasyon devam etmez. Hiler adenopati, eritema nodozum, anterior üveit, izole yedinci sinir paralizisi, periartiküler şişme ve asemptomatik hastalar akut hastalığın bulgularıdır.[2] Akut hastalıkta; tek organ tutulumu varsa topikal tedaviler (emilimi minimal olan yüksek potensli topikal kortikosteroidler, göz damlaları, perioküler steroid enjeksiyonları, topikal takrolimus ve laser tedavisi) verilmelidir.[3,5] Şekil 6.1’de akut sarkoidozda tedavi görülmektedir.[1] Yaygın cilt tutulumunda hidroksiklorakin verilir. Topikal tedaviye yanıt alınamayan tek organ tutulumlu hastalarda prednizon başlanmalıdır. Çoklu organ tutulumunda ise hastalara prednizon verilmelidir. Bu tedaviye yanıt verenlerde, doz azaltılarak devam edilmelidir. Prednizona yanıt vermeyen veya doz azaltıldığında yanıtsız hastalarda metotreksat kullanılmaktadır. Metotreksata yanıt alınamayan hastalarda klorokin ve azatiyoprin gibi ilaçlar düşünülmelidir. Tek organ tutulumu olan hastalarda, nörolojik veya kardiyak hastalık söz konusu ise çoklu organ tutulumu gibi değerlendirilerek prednizon başlanmalıdır.
Kronik hastalık: Tanıdan 5 yıl sonra halen kalıcı olan tablodur. Pulmoner fibrozis, lupus pernio, panüveit, kardiyak hastalık, omurilik veya kranial kitle, nefrolitiyazis, kemik kistleri ve dispne kronik hastalığın bulgularıdır.[2] Kronik hastalıkta ilk seçilecek ilaç prednizondur.[1] İlaç 20-40 mg/gün dozunda başlanır ve hastalığı yeterince iyileşme sağlandıktan sonra kontrol altında tutabilecek minimum doz ile devam edilir.
10 mg/gün ve altındaki dozlarla hastalık kontrolü sağlanıyorsa tedaviye devam edilir; aksi halde doz azaltılamıyorsa yani doz azaltıldığında hastalık tablosunda kötüleşme var ise steroid yerine sitotoksik ajanlar gibi diğer alternatifler kullanılmalıdır. Şekil 6.2’de kronik sarkoidoz tedavisi görülmektedir. Steroidin yerine tek başına başlanan sitotoksik ilaca yanıt alınamazsa ikinci bir sitotoksik ilaç tedaviye eklenmelidir. Bu tedaviye de yanıt alınamazsa, infliksimab eklenmesi düşünülmelidir.
Glukokortikosteroid tedavi başlamadan önce, hastalar, komorbid hastalıklar (enfeksiyon, kalp yetmezliği, tromboembolik hastalık, pulmoner hipertansiyon vb.) yönünden değerlendirilmelidir; çünkü bu hastalıklara bağlı semptomlar steroidlere yanıt vermez.[6] Akciğer fonksiyon testleri (spirometri, TLC, diffüzyon kapasitesi), toraks HRCT ve sıklıkla ekokardiyografi yapılmaktadır. Oral glukokortikosteroidler, genellikle semptomlarda (öksürük, dispne vb.) ve radyolojik bulgularda en azından başlangıçta iyileşme sağlamaktadır. Ancak tedavinin uzun dönem etkilerinin belirsiz olması ve bilinen yan etkileri nedeniyle, hastalar dikkatle değerlendirilerek tedaviye başlanmalıdır.
Sarkoidozda en sık tutulan organ akciğerdir ve yine en sık tedavi endikasyonu, akciğer tutulumuna bağlı ortaya çıkmaktadır. Ancak hangi pulmoner sarkoidozlu hastalara tedavi verilmesi gerektiği çok tartışmalıdır. Burada, mevcut kılavuzlardaki öneriler doğrultusunda, hastayı değerlendiren klinisyenin vereceği karar önemlidir.
Pulmoner sarkoidozda steroid tedavi endikasyonları şunlardır: [6]
- Rahatsız edici pulmoner semptomların varlığı (öksürük, nefes darlığı, göğüs ağrısı, hemoptizi vb.)
- 3-6 aylık arayla yapılan değerlendirmede kötüleşen akciğer fonksiyonları; TLC’de %10 veya fazla azalma, FVC’de %15 veya fazla azalma, DLCO’da %20 veya fazla azalma veya gaz değişiminde istirahatta veya egzersiz ile kötüleşme (pulse oksimetre ile %4 veya daha fazla azalma)
- Progresif radyolojik değişiklikler; intertisyel opasitelerde kötüleşme, kavitelerde ilerleme, bal peteği görünümü ile ilerleyici fibrozis veya pulmoner hipertansiyon bulgularında ilerleme
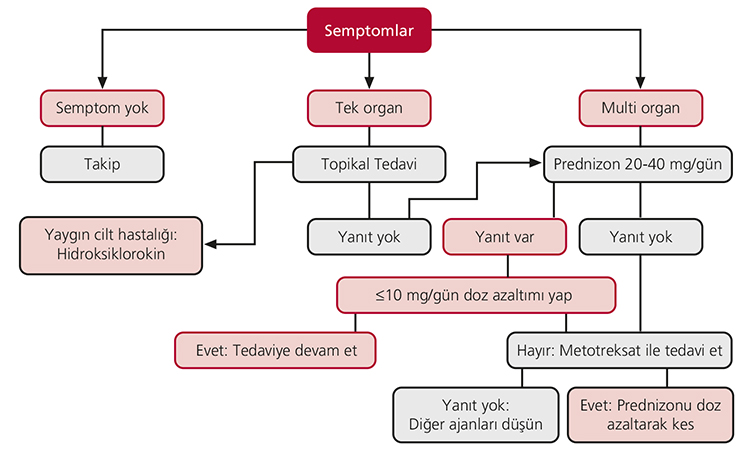
Şekil 6.1: Akut sarkoidoz tedavisi. Nörolojik veya kardiyak tutulum dâhil a¤›r tek organ sarkoidozu da, multi-organ sarkoidoz gibi tedavi edilmelidir.[1]
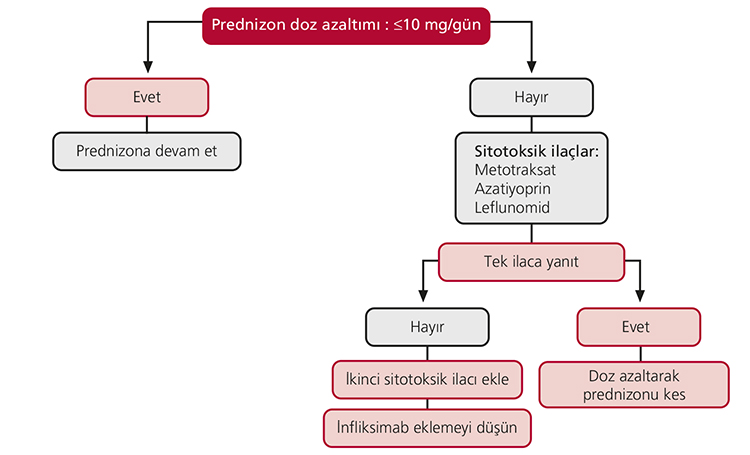
Şekil 6.2: Kronik sarkoidoz tedavisi.[1]
Aşağıdaki hastalarda pulmoner sarkoidozda steroid tedavisi endike değildir: [6]
- Asemptomatik evre I radyolojik bulguları olan hastalar
- Asemptomatik evre II radyolojik bulguları olan ve normal veya hafif bozulmuş akciğer fonksiyonları (hafif restriktif veya obstrüktif bulgular ile normal gaz değişimi) olan hastalar. Bu hastalar 3-6 ay arayla takip edilmelidir.
- Asemptomatik evre III hastalığı ve normal veya hafif akciğer fonksiyon bozukluğu olan hastalar. Bu hastalar 3-6 ay arayla yakın takip edilmelidir.
Ekstrapulmoner sarkoidoz tedavisinde tedavi kararı; etkilenen organ sistemi ve klinik ve laboratuvar inceleme ile hastalığın ağırlığının değerlendirilmesine bağlıdır. Göz tutulumu, nörolojik tutulum, miyokardiyal tutulum, renal tutulum, hiperkalsemi varlığında, semptomlar hafif olsa dahi görme kaybı, fatal aritmi veya ciddi renal hasar riski olduğu için steroid tedavi endikasyonu vardır.[6]
Sarkoidozda potensiyel steroid tedavi endikasyonları şunlardır: [6]
- Ateş, yorgunluk, halsizlik, artralji nedeniyle çalışamama veya hastada ciddi rahatsızlık ortaya çıkması
- Şekil bozukluğu yapan cilt tutulumu
- Üst solunum yolu tutulumu
- Hepatik yetmezlik
Refrakter hastalık; yeterli sistemik tedaviye rağmen kötüleşen kronik tablodur.[1] Refrakter hastalıkta; hastaların tedaviye yanıtsız kalmasının birçok sebebi olabilir. Bunlar arasında; tedaviye kompliyans olmayışı, enflamasyonun olmadığı fibrotik hastalık, pulmoner hipertansiyon, hidrosefali veya katarakt gibi hastalığın sekonder komplikasyonlarının varlığı, uygulanan tedavinin komplikasyonları ve steroid direnci yer almaktadır. Refrakter hastalıkta talidomid, infliksimab, etanersept ve adalimumab gibi ilaçlar kullanılmaktadır.
Glukokortikosteroidler, sarkoidozda tedavinin temelidir. Ancak çeşitli nedenlerle bu ilaçlarla, bazı hastalarda istenen yanıt alınamamakta veya yan etkileri nedeniyle ilaç kullanılamamakta veya ilaca karşı direnç saptanmaktadır.
Glukokortikosteroid dışındaki tedavilerin düşünülmesi gereken durumlar aşağıda verilmiştir:
- Yeterli steroid tedaviye (15 mg/gün ve daha fazlası prednizon en az 3 ay kullanılması) rağmen hastalığın progresyonu.
- Tolere edilemeyen steroid yan etkileri (aşırı kilo alımı, miyopati, osteoporoz, diabetes mellitusun kontrolünde zorluk)
- Uzun dönem steroid tedavi ihtiyacı olduğu halde, 10-15 mg/gün prednizon idame dozuna doz azaltılması yapılamayan ve steroid tedavi ile en az bir kayıtlı problem yaşayan hastalar.
- Steroid tedavi almak istemeyen hastalar
İlaçlar
Sarkoidoz tedavisinde çok çeşitli ilaçlar kullanılmıştır. Bu ilaçlar içerisinde, en çok bilinen ve en yaygın kullanılan ilaç, sistemik glukokortikosteroidlerdir. İkinci tercih ilaçlar olarak; metotreksat, azatiyoprin, leflunomid, mikofenolat mofetil, siklofosfamid, talidomid yer almaktadır. Ayrıca antimalaryal ilaçlar da kullanılmaktadır. Son yıllarda, yeni grup ilaçlar olarak anti-TNF ilaçlar; infliksimab, adalimumab, etanersept, golimumab kullanılmaya başlanmıştır. Sarkoidoz tedavisinde, bosentan, pentoksifilin, siklosporin, klorambusil, kolşisin, tetrasiklinler, nonsteroid antienflamatuar ilaçlar da kullanılmış, olup bir kısmı deneysel aşamadadır ve bir kısmının da sarkoidozda kullanımı önerilmemektedir. Tablo 6.1‘de sarkoidoz tedavisinde kullanılan ilaçlar görülmektedir.
Sistemik kortikosteroidler
Sarkoidoz tedavisinde kortikosteroid tedavisinin başlanması için pulmoner sarkoidozda ve ekstrapulmoner sarkoidozda tedavi endikasyonları önerilmiş olmasına rağmen kesin kriterler yoktur. Hastaların büyük kısmında spontan remisyon görülmekte, steroidlerin uzun dönem etkileri bilinmemekte ve bu ilaçların önemli yan etkileri görülmektedir. İlk olarak 1950’li yıllarda, oral steroid ilaçlar, pulmoner sarkoidoz tedavisinde kullanılmıştır.[7] Glukokortikosteroid olarak sarkoidoz tedavisinde Amerika’da yaygın olarak prednizon ve Avrupa’da ise genellikle prednizolon kullanılmaktadır.[8] Her iki ilacın pulmoner ve ekstrapulmoner sarkoidoz tedavisinde kullanımı ile ilgili çok sayıda randomize çalışmalar yapılmıştır.[9] Bu çalışmaların sonuçları arasında farklılıklar bulunmakla beraber meta analiz sonucu; sarkoidoz tedavisinde kullanılan kortikosteroidlerin, akciğer grafisinde ve diffüzyon kapasitesinde (transfer faktör) çok önemli iyileşme sağladığı gösterilmiştir.[10] Ancak vital kapasitede önemli bir iyileşme görülmemiştir. Kortikosteroidler, kısa dönemde hastalık tedavisinde etkili olduğu halde; hastalığın progresyonunu etkilediğine dair bilgi yoktur.[11]
| Tablo 6.1: Sarkoidoz tedavisinde kullan›lan ilaçlar. ‹laçlar Bafllang›ç Dozu ‹dame Dozu Öneriler |
||||
|---|---|---|---|---|
| İlaçlar | Başlangıç Dozu | İdame Dozu | Öneriler | Yan Etkiler |
| Kortikosteroidler (Prednizon,prednizolon) | 20-40 mg/gün veya gün aşırı | 5-10 mg/gün veya gün aşırı | Sarkoidoz tedavisinde en önemli ilaç | Diyabet, hipertansiyon, osteoporoz, kilo artışı, enfeksiyon riskinde artış |
| Klorokin (Aralen) | 250-500 mg/gün | 250-500 mg/gün | Oküler toksisite, bulantı, raş | |
| Hidroksiklorokin (Plaquenil) | 200-400 mg/gün | 200-400 mg/gün | Yaygın cilt hastalığında faydalı | Oküler toksisite,raş |
| Metotreksat (Rheumatrex) | 10-20 mg/hafta; | 10-20 mg/hafta | Steroid yerine kullanılır; 6 ay içinde etkili olur | Bulantı, lökopeni, nötropeni, hepatotoksisite,pulmoner fibrozis, enfeksiyon riskinde artış |
| Azatiyoprin (Imuran) | 50-200 mg/gün; | 50-200 mg/gün | Metotreksattan daha az hepatotoksisite | Lökopeni, bulantı, hepatotoksisite,enfeksiyon riskinde artış |
| Talidomid (Thalomid) | 50-200 mg/gün; oral, geceleri | Cilt hastalığında etkili | Somnolans, teratojenite, kabızlık, periferik nöropati | |
| Siklofosfamid (Cytoxan) | Oral: 50-150 mg/gün ıv:500-1500mg/2-4 hafta |
Etkili ancak toksisite kullanımını sınırlıyor | Nötropeni, bulantı, sistik, karsinojenite, enfeksiyon riskinde artış | |
| Infliksimab (Remicade) | 3-5 mg/kg intravenöz 2 hafta bir, ilk iki doz | 3-5 mg/kg her 4-8 haftada bir | Kronik progresif diğer ilaçlar yanıtsız hastalarda | Enfeksiyon riskinde artış, allerjik reaksiyon, kalp yetmezliği hastalarına verilemez, muhtemel karsinojenite, teratojenik |
ATS/ERS/WASOG kılavuzu; pulmoner sarkoidozlu progresif semptomatik hastalığı olan veya asemptomatik olduğu halde grafide infiltrasyon bulunan ve akciğer fonksiyonlarında kötüleşme olan hastalarda 20-40 mg/gün dozunda oral steroid başlanmasını önermektedir.[12] Eşdeğer doz ilacın gün aşırı kullanımının yan etki sıklığını azaltmak için kullanıldığında, günlük kullanım ile benzer etkinliğe sahip olduğu görülmüştür. Tedavi başlangıcından 1-3 ay sonra kontrol yapılarak doz azaltılır ve 5-10 mg/gün dozunda tedaviye en az 12 ay devam edilmelidir.
Glukokortikosteroid tedaviye yanıt kriterleri şunlardır:[6]
- Semptomlarda özellikle yorgunluk, göğüs ağrısı, dispne, öksürük ve hemoptizi şikayetlerinde azalma
- Radyolojik anormalliklerde iyileşme veya gerileme
- FVC veya TLC’de %10-15 iyileşme, DLCO‘da %20 veya daha fazla artış veya gaz değişiminde iyileşme (istirahatta veya egzersiz sırasında, PaO2‘de 4 mmHg veya daha fazla artış veya alveole-arteryal oksijen gradiyentinde 4 mmHg veya daha fazla düşme)
BTS kılavuzu ise; asemptomatik evre I hastalığı olanlarda ve stabil seyreden, hafif akciğer fonksiyon anormalliği bulunan asemptomatik evre II veya evre III hastalığı olan hastalarda tedavi önermemektedir.[11] Ciddi semptomları olan veya radyolojik veya akciğer fonksiyon testlerinde hastalık progresyonu tespit edilen hastalara 0.5 mg/kg/gün oral steroid tedavi başlanmalıdır. Tedavi başlangıcından 4 ay sonra kontrol yapılarak doz azaltılır ve hastalık progresyonunu ve semptomları kontrol eden dozda tedaviye en az 6-24 ay devam edilmelidir.
Oral glukortikortikosteroidler, pulmoner sarkoidoz tedavisinde; persistan, ciddi veya kötüleşen akciğer semptomları veya akciğer fonksiyonları olan hastalarda kullanılmalıdır. Akciğer fonksiyon testlerinde; vital kapasitede %10-15 azalma ve/veya TLCO‘da > %20 azalma tedavi endikasyonu olarak değerlendirilmektedir.[11]
Kronik glukokortikosteroid tedavisinde en önemli problem, toksisitedir. Steroid tedavisi sırasında görülen ilaca bağlı yan etkiler, ilacın dozuna ve kullanım süresine bağlıdır. Steroidlerin yerine kullanılan ajanların artmasıyla, steroidlere bağlı toksisite daha önemli hale gelmiştir. Kilo artışı, kronik hastalık tedavisinde uzamış steroid tedavisi ile birliktedir.[13] Prednizon dozunun düzeyi, kilo artış miktarını belirlemektedir. Steroide bağlı diyabet, var olan diyabetin kötüleşmesi, enfeksiyon riskinin artması, ciltte incelme, uyku bozuklukları ve hipertansiyon da bu ilaçların yan etkilerindendir.[14,15] Osteopeni ve osteoporoz, kronik steroid kullanımının komplikasyonları arasında olup, 10 mg/gün ve daha azı dozunda prednizon veya eşdeğeri ilacı kullananlarda dahi görülmektedir.[16] Özellikle postmenopozal kadınlar risk altındadır.
Steroidlerin yan etkilerinin önlenmesi ve takibi ile ilgili özel kılavuzlar yoktur. Bu yan etkilerin bir kısmı, tedavide etkin en düşük doz tercih edilmesi, rutin ve kontrollerin düzenli yapılması ve uygun profilaksilerin uygulanması ile önlenebilmektedir. Steroid kullanan hastalarda osteoporoz için rutin kemik mineral dansitesi ölçümleri önerilmektedir.[17] Ölçümde T skoru – 1.5 veya daha düşük hastalara ilaç tedavisi verilmektedir.[18] Osteoporoz riski olan hastalarda destek kalsiyum (1500 mg/gün) ve D vitamini (800 IU/gün) verilmesi önerilmiştir.[19] Ancak, hiperkalsemi ve verilen hastalarda bisfosfonatların kullanımıdır. Bu ilaçlar, steroidler için ilk basamak korumada kalsiyum ve D vitamininin yerine kullanılabilmektedir. Bu amaçla, alendronat 35 mg/hafta veya risedronat 35 mg/hafta kullanılmaktadır.[20] Bifosfonatların en önemli yan etkisi, mandibula osteonekrozudur.[21] Bu nedenle, bifosfonat kullanacak hastalara, başlangıçta dental muayene yapılması ve uygun önleyici tedbirlerin alınması önerilmektedir. Bifosfonatların hamilelikte kullanımı önerilmemektedir.[8] Bu nedenle, çocuk doğurma çağındaki kadın hastalarda bu durum dikkate alınmalı ve hastalara bu konuda bilgi verilmelidir. Bifosfonatları tolere edemeyen veya kontraendike olan hastalarda kalsitonin önerilmektedir.[18]
Metotreksat
Metotreksat folik asit analoğudur ve dihidrofolat redüktaz enzimini ve transmetilasyon reaksiyonlarını inhibe eder. Düşük dozlarda, adenozinin salımının artmasına bağlı antiiflamatuvar etkileri vardır.[8] Adenozin, monosit, makrofaj ve nötrofillerden TNF-a salınımını ve nötrofil reaktif oksijen radikalleri salınımını baskılar ve lenfosit proliferasyonun inhibe eder.
Metoreksat, sarkoidoz tedavisinde yaygın olarak kullanılan sitotoksik bir ajandır. Romatoid artrit tedavisinde yıllarca steroidlerin yerine kullanılmıştır. Akciğer, cilt, göz sarkoidozu ve nörolojik sarkoidozda etkili olduğu gösterilmiştir.[22,23] Yaklaşık hastaların üçte ikisi tedaviye yanıt vermektedir.[22] Pulmoner sarkoidozda, steroidlerin yerine kullanılacak ilaçlar arasında ilk tercih edilecek ilaçtır. Metotreksat, iyi tolere edilmekte olup, bulantı ve lökopeni en sık görülen yan etkileridir. Bu yan etkiler, genellikle doz azaltımı ile gerilemektedir.[23] Metotreksat tedavisinde daha az görülen fakat ciddi komplikasyonlar ise; pulmoner toksisite ve fırsatçı enfeksiyon riskinin artmasıdır.[24] Hepatotoksisite, diğer bir bildirilen yan etkidir ve hastaların bu yönden takip edilmesi gerekmektedir.[25] Kronik tedavi alan hastalarda, 2-3 ayda bir karaciğer fonksiyonları kontrol edilmelidir. Persistan transaminaz yüksekliği olan hastalarda, başka bir sebep yoksa hastaya karaciğer biyopsisi yapılmalı ve metotreksat kesilmelidir. Her ne kadar alkalin fosfotaz yüksekliği sarkoidozun karaciğer tutulumunda daha sık görülse de, transaminaz yüksekliği de bu nedenle ortaya çıkabilmektedir. Toksik etkilerinin azaltılması için ilacı kullananlarda, haftada bir kez ve ilacı aldıktan sonraki gün 5-10 mg folik asit verilmesi önerilmiştir. Metotreksat, teratojenik bir ilaçtır. Tedavi başlanmadan önce kadınlarda hamilelik dışlanmalıdır. İlacı kullanıldığı sürece ve ilaç kesildikten sonra 3 ay süreyle kadın ve erkek tüm hastalar, etkili kontrasepsiyon uygulamalıdır.
Azatiyoprin
Azatiyoprin, bir pürin analoğudur. Vücutta, RNA ve DNA sentezini etkileyen merkaptoprine çevrilir. Hücresel immüniteyi, humoral immüniteye göre daha fazla baskılamaktadır. Sarkoidoz tedavisinde yaygın olarak kullanılmıştır. Ancak tedavi başarı oranları değişkendir. Bazıları yüksek bir tedavi oranı bildirirken,[26] diğerleri %20 ve altında oranlar bildirmiştir.[27] Oküler sarkoidozlu hastalarda metotreksata yanıt vermeyen hastalarda tek başına kullanılan azatiyoprinin tedavi başarısı %29 bulunmuştur.[1] Bu ilaçlar kombine olarak kullanıldıklarında ise hastaların %70’den fazlasında tedavi etkili olmuştur. Pulmoner sarkoidozda, nefes darlığı ve grafilerde iyileşme sağladığı görülmüştür.[26] Ancak, sarkoidozda azatiyoprinin steroidin yerine kullanılabilecek etkili bir ilaç olup olmadığı ile ilgili ileri çalışmalara ihtiyaç vardır. Azatiyoprinin toksisite profili metotreksata benzemektedir. İlacı kullananlarda bulantı ve lökopeni yan etkisi görülmektedir.[28] Azatiyoprinin metabolize edilmesinde rol alan enzim olan tioprin-metil-transferaz (TPMT) enziminin eksikliğinde veya aktivitesinin düşük olduğu hastalarda ciddi nötropeni riski vardır.[28,29] Bu nedenle 4 haftada bir beyaz küre sayımının bakılması önerilmektedir. Azatiyoprinin en önemli avantajı; metotreksat ile kıyaslandığında hepatoksisite yan etkisinin daha az olmasıdır ve bu nedenle hepatik sarkoidozlu steroid yerine kullanılabileceği bildirilmiştir.[30] Gebelik sırasında, prematür doğum, düşük doğum ağırlığı ve spontan abortusa neden olabildiği için kullanılmaması önerilmektedir.
Siklofosfamid
Siklofosfamid, güçlü bir alkilize eden sitotoksik bir ilaç olup, refrakter nörosarkoidoz ve kardiyak sarkoidoz tedavisinde etkili olduğu bildirilmiştir.[31] Pulmoner sarkoidozda kullanımı ile ilgili yeterli veri yoktur. İki haftada bir yani intermittan olarak intravenöz verildiğinde günlük oral kullanıma benzer etkinlik görülmektedir ve yan etki sıklığı azalmaktadır.[32] Nötropeni, bulantı, hemorajik sistit ve malignite riskinin artması, ilacın en önemli komplikasyonlarıdır ve refrakter hastalıkta kullanımını sınırlamaktadır.[33]
Antimalaryal ilaçlar (Klorokin, hidroksiklorokin)
Sarkoidoz tedavisinde yaygın olarak iki antimalaryal ilaç kullanılmaktadır. Bunlar; klorokin ve hidroksiklorokindir. Özellikle hiperkalsemi, cilt sarkoidozu ve nörolojik tutulumda kullanılmıştır.[34-36] Her ne kadar her iki ilacın da sarkoidoz tedavisinde kullanımı ispatlanmışsa da klorokinin tedavideki bildirilen yanıt oranları hidroksiklorokinden yüksektir.[37] Klorokinin, ayrıca kronik pulmoner hastalığın ilerlemesini yavaşlattığı gösterilmiştir.[38] Klorokin, buna rağmen daha fazla toksik bir ilaç olup, özellikle direk retinal hasar potensiyeli vardır.[39] Renal disfonksiyon, oküler toksisite için risk faktörüdür.[39] Hidroksiklorokinin, retinal toksisite yan etkisi daha az görülmektedir ve genellikle 400 mg/gün dozundan daha yüksek dozlarda tedavi alan hastalarda ortaya çıkmaktadır.[40] Tedavi başlanacak hastalara, başlangıçta göz hastalığı sorgulanmalı ve hastalık varsa göz hastalıkları konsültasyonu alınmalıdır. Antimalaryal ilaçlarla tedavi edilen sarkoidoz hastalarına, özellikle tedavi süresi 5 yıldan uzun süren hastalarda, 6-12 ayda bir göz hastalıkları uzmanı tarafından oküler toksisite tarama muayenesi önerilmektedir.[41]
Klorokin, kronik pulmoner sarkoidoz tedavisinde düşünülmelidir; ancak toksik etkilerinin yüksek olması nedeniyle hidrokiklorokin tercih edilmelidir. Hidroksiklorokin, karaciğer veya renal hastalığı olanlarda dikkatle kullanılmalıdır. Hidroksiklorokin, glukoz-6-fosfotaz eksikliği olanlarda akut hemolitik anemiye neden olabileceği için dikkatle kullanılmalı, hatta tedavi öncesinde glukoz-6-fozfotaz düzeyleri kontrol edilmelidir.[8] İlacı kullananlarda, agranülositoz ve trombositopeni komplikasyonları için rutin tam kan sayımı ve karaciğer fonksiyonlarının takibi önerilmektedir.
Leflunomid
İlaç, romatoid artrit tedavisinde metotraksata alternatif olarak geliştirilmiştir. Gastrointestinal yan etkileri azdır ancak hepatotoksiktir. Kronik sarkoidoz tedavisinde etkili olduğu gösterilmiştir ve tedavi yanıt oranları metotreksata benzerdir.[42] Azatiyoprin gibi, leflunomid de toksisitedeki farklılıklar nedeniyle metotreksata mantıklı bir alternatif olabilir. Sarkoidoz tedavisinde metotreksat ile kombine kullanılabilir.[43] Hepatoksisite nedeniyle 2-3 yada bir karaciğer fonksiyon testleri kontrol edilmelidir.
Kofenolat mofetil (MMF)
Azatiyoprin gibi antiproliferatif immünosupresif bir ilaçtır. Aktive makrofaj, T ve B lenfositlerde pürin nükleotid guanin sentezinden sorumlu inozin monofosfat dehidrojenaz tip II enziminin selektif bir inhibitörüdür. Organ transplantasyonunda iyi bilinen güçlü bir immünosupresandır. Kutanöz veya renal sarkoidozu olan hastaların tedavisinde etkili olduğu bildirilmiştir.[44,45] Ekstrapulmoner sarkoidozda steroidin yerine başarıyla kullanılabileceği bildirilmekle beraber pulmoner sarkoidozda kullanımı ile ilgili yeterli veri yoktur. Geleneksel sitotoksik ajanlara oranla, nötropeni daha az görülür. Diyare ve bulantı, ilacın diğer yan etkileridir.
Talidomid
Talidomid, alveoler makrofajlardan TNF salınımını baskılamaktadır. Sarkoidozda, enflamatuar yanıtta rol alan birçok sitokini etkilediği düşünülmektedir.[46] İlaç, lupus pernio gibi kronik kutanöz sarkoidoz tedavisinde etkilidir.[47] Nonkutanöz sarkoidozda, hem faydaları, hem de sınırlı bir yanıt bildirilmiştir.[48] Kronik pulmoner hastalıkta, çok etkili değildir.[49] Hipersomnolans, kabızlık ve periferik nöropati, doza bağlı yan etkileridir. Bazı sistemik tutulumlar için gereken yüksek dozlar iyi tolere edilemeyebilir. Talidomid ayrıca, teratojenik bir ilaçtır ve bu etki doz bağımlı değildir.
Anti-TNF-a tedavisi
İnfliksimab: İnfliksimab, bir şimerik monoklonal antikordur ve 2000’li yıllarda sarkoidoz tedavisinde kullanıma başlanmıştır. Kronik pulmoner sarkoidoz, refrakter cilt, göz ve nörolojik sarkoidoz tedavisinde etkili olduğu gösterilmiştir.[50] Refrakter pulmoner sarkoidozda, hastalığın ciddiyeti arttıkça, yani hastalık süresi daha uzun, daha düşük FVC değerine sahip ve daha fazla semptomu olan hastalar infliksimab tedavisinden daha fazla fayda görmektedir.[51] İnfliksimab, tüm diğer tedavi seçenekleri tükendiğinde, hayatı tehdit eden pulmoner sarkoidozda, tercih edilmelidir. İlaç başlangıçta haftada iki kez intravenöz olarak uygulanır ve sonra 4-8 hafta arayla uygulamaya devam edilir. Etki genelde 6 haftalık tedavi sonrası ortaya çıkar. Tedavi sırasında infüzyon reaksiyonları görülebilir.[52] İlaçla ilgili diğer bir problem ise özellikle tüberküloz gibi enfeksiyonların tedavi sırasında riskinin artmasıdır.[53,54] Anti-TNF biyolojik ajanları ile ileri konjestif kalp yetmezliği olan hastalarda mortalite artmıştır.[55] Diğer bir yan etki, ilacı kullananlarda kanser riskinin artmasıdır. İlacı kullanan Crohn hastalarında lenfoma riski artmıştır.[56] Ayrıca, ilginç bir şekilde başka bir hastalık nedeniyle ilacı kullanan hastalarda sarkoidoz geliştiği bildirilmiştir.[57] İlaç maliyeti yüksektir ve tedavi öncesi ve tedavi sırasında tüberküloz yönünden hastalar yakın takibe alınmalıdır.
Adalimumab: Humanize monoklonal anti-TNF antikorudur. İntravenöz olarak kullanılan infliksimabdan farklı olarak subkutan kullanılır. Sarkoidoz tedavisinde, infliksimab ile benzer etkinliğe sahip olmasına rağmen tedaviye yanıt oranları daha düşüktür.[58] İnfliksimaba intoleransı olan hastalarda kullanılabilir.[59]
Etanersept: Dolaşımdaki TNF’e bağlanan, spesifik anti-TNF aktivitesi olan TNF reseptörüdür. Sarkoidoz tedavisinde, infliksimab kadar etkin değildir.[8] Bunun muhtemel sebebi; infliksimabın yüksek doku penetrasyonu ve TNF-salınan hücrelerde, hücre aracılı lizis özelliklerine sahip olmasıdır.
Lokal (topikal, inhaler) kortikosteroid tedavisi
Pulmoner sarkoidozda topikal tedavinin rolü tartışmalıdır. Budesonid, en sık kullanılan inhale steroidtir. Plasebo kontrollü bir çalışmada, 18 aylık tedavi sonrasında, budesonid plaseboya göre etkin bulunmuştur.[60] Yine başka bir çalışmada 3 aylık oral steroid sonrası inhaler budesonid verilen hastalar, oral steroid sonrası plasebo alan hastalara göre, özellikle parankim hastalığı olanlarda daha belirgin olmak üzere fayda sağladığı görülmüştür.[61] İnhale flutikazon ile yapılan çalışmalarda, akciğer fonksiyonlarında belirgin iyileşme sağladığına veya oral steroidin yerine kullanılabileceğine dair sonuçlar elde edilememiştir.[62,63] Flutikazonun, akut sarkoidozda öksürüğe etkili olduğu bir çalışmada görülmüştür.[62]
İnhaler steroidler, pulmoner sarkoidozda, oral steroidler kadar etkili değildir. Bunun sebebi, bu ilaçların akciğer parankimi yerine daha çok havayolları üzerinde etki göstermesidir. Hastalık tedavisinde rutin kullanımları önerilmemektedir. Sadece endobronşiyal tutulumu olan veya ana semptomu öksürük olan hastalarda kullanımı önerilmektedir.[11]
Kaynaklar
- Baughman RP, Costabel U, du Bois RM. Treatment of sarcoidosis. Clin Chest Med 2008;29:533-48.
- Neville E, Walker AN, James DG. Prognostic factors predicting the outcome of sarcoidosis: an analysis of 818 patients. Q J Med 1983;52:525-33.
- Bradley D, Baughman RP, Raymond L, Kaufman AH. Ocular manifestations of sarcoidosis. Semin Respir Crit Care Med 2002;23:543-8.
- Katoh N, Mihara H, Yasuno H. Cutaneous sarcoidosis successfully treated with topical tacrolimus. Br J Dermatol 2002;147:154-6.
- Cliff S, Felix RH, Singh L, Harland CC. The successful treatment of lupus pernio with the flashlamp pulsed dye laser. J Cutan Laser Ther 1999;1:49-52.
- Talmadge EK, Kevin RF, Helen H. Treatment of pulmonary sarcoidosis with glucocorticoids. http://www.uptodate.com/contents/treatment of pulmonary sarcoidosis with glucocorticoids.
- Siltzbach LE. Effects of cortisone in sarcoidosis; a study of thirteen patients. Am J Med 1952;12: 139-60.
- Coker RK. Management strategies for pulmonary sarcoidosis. Ther Clin Risk Manag 2009;5:575-84.
- Grutters JC, van den Bosch JM. Corticosteroid treatment in sarcoidosis. Eur Respir J 2006;28: 627-36.
- Paramothayan NS, Lasserson TJ, Jones PW. Corticosteroids for pulmonary sarcoidosis. Cochrane Database Syst Rev 2005;(2): CD001114.
- Bradley B, Branley HM, Egan JJ, et al. British Thoracic Society Interstitial Lung Disease Guideline Group, British Thoracic Society Standards of Care Committee; Thoracic Society of Australia; New Zealand Thoracic Society; Irish Thoracic Society. Interstitial lung disease guideline: the British Thoracic Society in collaboration with the Thoracic Society of Australia and New Zealand and the Irish Thoracic Society. Thorax 2008;63 Suppl 5:v1-58.
- Costabel U, Hunninghake GW. ATS/ERS/ WASOG statement on sarcoidosis. Sarcoidosis Statement Committee. American Thoracic Society. European Respiratory Society. World Association for Sarcoidosis and Other Granulomatous Disorders. Eur Respir J 1999;14: 735-7.
- McDonough AK, Curtis JR, Saag KG. The epidemiology of glucocorticoid-associated adverse events. Curr Opin Rheumatol 2008;20:131-7.
- Gostiljac DM, Dordeviç PB, Filipoviç S, Canoviç F. Sarcoidosis and diabetes: therapeutic aspects. Med Pregl 2005;58 Suppl 1:46-50.
- Ligon CB, Judson MA. Impact of systemic corticosteroids on healthcare utilization in patients with sarcoidosis. Am J Med Sci 2011;341:196-201.
- Ton FN, Gunawardene SC, Lee H, Neer RM. Effects of low-dose prednisone on bone metabolism. J Bone Miner Res 2005;20:464-70.
- Adler RA, Hochberg MC. Suggested guidelines for evaluation and treatment of glucocorticoid-induced osteoporosis for the Department of Veterans Affairs. Arch Intern Med 2003;163: 2619-24.
- Bone and Tooth Society of Great Britain, National Osteoporosis Society, Royal College of Physicians. Management of glucocorticoid-induced osteoporosis in men and women. Glucocorticoid-induced osteoporosis: guidelines for prevention and treatment. London: Royal College of Physicians of London; 2002.
- Grossman JM, Gordon R, Ranganath VK, et al. American College of Rheumatology 2010 recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Care Res (Hoboken) 2010;62:1515-26.
- Gonnelli S, Rottoli P, Cepollaro C, et al. Prevention of corticosteroid-induced osteoporosis with alendronate in sarcoid patients. Calcif Tissue Int 1997;61:382-5.
- Migliorati CA, Siegel MA, Elting LS. Bisphosphonate-associated osteonecrosis: a long-term complication of bisphosphonate treatment. Lancet Oncol 2006;7:508-14.
- Vucinic VM. What is the future of methotrexate in sarcoidosis? A study and review. Curr Opin Pulm Med 2002;8:470-6.
- Baughman RP, Lower EE. A clinical approach to the use of methotrexate for sarcoidosis. Thorax 1999;54:742-6.
- Zisman DA, McCune WJ, Tino G, Lynch JP 3rd. Drug-induced pneumonitis: the role of methotrexate. Sarcoidosis Vasc Diffuse Lung Dis 2001;18:243-52.
- Baughman RP, Koehler A, Bejarano PA, Lower EE, Weber FL Jr. Role of liver function tests in detecting methotrexate-induced liver damage in sarcoidosis. Arch Intern Med 2003;163:615-20.
- Müller-Quernheim J, Kienast K, Held M, Pfeifer S, Costabel U. Treatment of chronic sarcoidosis with an azathioprine/prednisolone regimen. Eur Respir J 1999;14:1117-22.
- Lewis SJ, Ainslie GM, Bateman ED. Efficacy of azathioprine as second-line treatment in pulmonary sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 1999;16:87-92.
- Escousse A, Mousson C, Santona L, et al. Azathioprine-induced pancytopenia in homozygous thiopurine methyltransferase-deficient renal transplant recipients: a family study. Transplant Proc 1995;27:1739-42.
- Mircheva J, Legendre C, Soria-Royer C, Thervet E, Beaune P, Kreis H. Monitoring of azathioprine-induced immunosuppression with thiopurine methyltransferase activity in kidney transplant recipients. Transplantation 1995;60:639-42.
- Kennedy PT, Zakaria N, Modawi SB, et al. Natural history of hepatic sarcoidosis and its response to treatment. Eur J Gastroenterol Hepatol 2006;18:721-6.
- Doty JD, Mazur JE, Judson MA. Treatment of corticosteroid-resistant neurosarcoidosis with a short-course cyclophosphamide regimen. Chest 2003;124:2023-6.
- Baughman RP, Lower EE. Use of intermittent, intravenous cyclophosphamide for idiopathic pulmonary fibrosis. Chest 1992;102:1090-4.
- Talar-Williams C, Hijazi YM, Walther MM, et al. Cyclophosphamide-induced cystitis and bladder cancer in patients with Wegener granulomatosis. Ann Intern Med 1996;124:477-84.
- Sharma OP. Effectiveness of chloroquine and hydroxychloroquine in treating selected patients with sarcoidosis with neurological involvement. Arch Neurol 1998;55:1248-54.
- Sinha RN, Fraser WD, Casson IF. Long-term management of hypercalcaemia in chronically active sarcoidosis. J R Soc Med 1997;90:156-7.
- Liedtka JE. Intralesional chloroquine for the treatment of cutaneous sarcoidosis. Int J Dermatol 1996;35:682-3.
- Baughman RP, Lower EE. Evidence-based therapy for cutaneous sarcoidosis. Clin Dermatol 2007;25:334-40.
- Baltzan M, Mehta S, Kirkham TH, Cosio MG. Randomized trial of prolonged chloroquine therapy in advanced pulmonary sarcoidosis. Am J Respir Crit Care Med 1999;160:192-7.
- Leecharoen S, Wangkaew S, Louthrenoo W.Ocular side effects of chloroquine in patients with rheumatoid arthritis, systemic lupus erythematosus and scleroderma. J Med Assoc Thai 2007;90:52-8.
- Yam JC, Kwok AK. Ocular toxicity of hydroxychloroquine. Hong Kong Med J 2006;12:294-304.
- Marmor MF, Carr RE, Easterbrook M, Farjo AA, Mieler WF; American Academy of Ophthalmology. Recommendations on screening for chloroquine and hydroxychloroquine retinopathy: a report by the American Academy of Ophthalmology. Ophthalmology 2002;109: 1377-82.
- Majithia V, Sanders S, Harisdangkul V, Wilson JG. Successful treatment of sarcoidosis with leflunomide. Rheumatology (Oxford) 2003;42:700-2.
- Baughman RP, Lower EE. Leflunomide for chronic sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2004;21:43-8.
- Kouba DJ, Mimouni D, Rencic A, Nousari HC. Mycophenolate mofetil may serve as a steroid-sparing agent for sarcoidosis. Br J Dermatol 2003;148:147-8.
- Moudgil A, Przygodzki RM, Kher KK. Successful steroid-sparing treatment of renal limited sarcoidosis with mycophenolate mofetil. Pediatr Nephrol 2006;21:281-5.
- Ye Q, Chen B, Tong Z, et al. Thalidomide reduces IL-18, IL-8 and TNF-alpha release from alveolar macrophages in interstitial lung disease. Eur Respir J 2006;28:824-31.
- Nguyen YT, Dupuy A, Cordoliani F, et al. Treatment of cutaneous sarcoidosis with thalidomide. J Am Acad Dermatol 2004;50:235-41.
- Baughman RP, Judson MA, Teirstein AS, Moller DR, Lower EE. Thalidomide for chronic sarcoidosis. Chest 2002;122:227-32.
- Judson MA, Silvestri J, Hartung C, Byars T, Cox CE. The effect of thalidomide on corticosteroid-dependent pulmonary sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2006;23:51-7.
- Doty JD, Mazur JE, Judson MA. Treatment of sarcoidosis with infliximab. Chest 2005;127:1064-71.
- Baughman RP, Drent M, Kavuru M, et al. Infliximab therapy in patients with chronic sarcoidosis and pulmonary involvement. Am J Respir Crit Care Med 2006;174:795-802.
- Kapetanovic MC, Larsson L, Truedsson L, Sturfelt G, Saxne T, Geborek P. Predictors of infusion reactions during infliximab treatment in patients with arthritis. Arthritis Res Ther 2006;8:R131.
- Kroesen S, Widmer AF, Tyndall A, Hasler P. Serious bacterial infections in patients with rheumatoid arthritis under anti-TNF-alpha therapy. Rheumatology (Oxford) 2003;42:617-21.
- Keane J, Gershon S, Wise RP, et al. Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 2001;345(15):1098-104.
- Chung ES, Packer M, Lo KH, Fasanmade AA, Willerson JT; Anti-TNF Therapy Against Congestive Heart Failure Investigators. Randomized, double-blind, placebo-controlled, pilot trial of infliximab, a chimeric monoclonal antibody to tumor necrosis factor-alpha, in patients with moderate-to-severe heart failure: results of the anti-TNF Therapy Against Congestive Heart Failure (ATTACH) trial. Circulation 200;107:3133-40.
- Hansen RA, Gartlehner G, Powell GE, Sandler RS. Serious adverse events with infliximab: analysis of spontaneously reported adverse events. Clin Gastroenterol Hepatol 2007;5:729-35.
- Almodóvar R, Izquierdo M, Zarco P, Javier Quirós F, Mazzucchelli R, Steen B. Pulmonary sarcoidosis in a patient with ankylosing spondylitis treated with infliximab. Clin Exp Rheumatol 2007;25:99-101.
- Baughman RP, Lower EE, Drent M. Inhibitors of tumor necrosis factor (TNF) in sarcoidosis: who, what, and how to use them. Sarcoidosis Vasc Diffuse Lung Dis 2008;25:76-89.
- Sandborn WJ, Rutgeerts P, Enns R, et al. Adalimumab induction therapy for Crohn disease previously treated with infliximab: a randomized trial. Ann Intern Med 2007;146:829-38.
- Pietinalho A, Tukiainen P, Haahtela T, Persson T, Selroos O. Oral prednisolone followed by inhaled budesonide in newly diagnosed pulmonary sarcoidosis: a double-blind, placebo-controlled multicenter study. Finnish Pulmonary Sarcoidosis Study Group. Chest 1999;116:424-31.
- Pietinalho A, Tukiainen P, Haahtela T, Persson T, Selroos O; Finnish Pulmonary Sarcoidosis Study Group. Early treatment of stage II sarcoidosis improves 5-year pulmonary function. Chest 2002;121:24-31.
- Baughman RP, Iannuzzi MC, Lower EE, et al. Use of fluticasone in acute symptomatic pulmonary sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2002;19:198-204.
- du Bois RM, Greenhalgh PM, Southcott AM, Johnson NM, Harris TA. Randomized trial of inhaled fluticasone propionate in chronic stable pulmonary sarcoidosis: a pilot study. Eur Respir J 1999;13:1345-50.
