Sarkoidoz, eski Yunanca’da kilolu durum anlamına gelmektedir ki hastalığın belirtisi olan organ tutulumundaki lezyonları işaret etmektedir. İlk kez 1899 yılında Dr. Boeck tarafından tarif edilmiştir.
Bilinmeyen antijen, bilinmeyen yatkınlık ve bilinmeyen faktörlerin sorumlu olduğu bilinmeyenler hastalığı olarak anılır.[1] Hastalığın immünopatogenezi henüz aydınlatılmamış olmak ile birlikte butyrophilin benzeri 2 (BTNL2) geninin bulunması ve granülom oluşumunda mikobakteriyel katalaz peroksidaz’ın (mKat G) sarkoid antijeni olarak tanımlanması, serum amiloid A’nın antijen sunucu hücreyi uyardığının gösterilmesi en güncel bilgilerdir.[2-4]
HLA ailesindeki genler üzerine yapılan polimorfizm çalışmalarda spesifik HLA-DR, -DQ ve –DP alleleri ile sarkoidoz arasında ilişki ortaya konmuştur. Bu ilişki ırklara göre farklılık göstermektedir. ACCESS çalışması sonucunda HLA-DRB*1101 ile sarkoidoz arasında ilişki ortaya konmuş olmasına rağmen sarkoidozdaki genetik yatkınlık henüz aydınlatılamamıştır.[5]
Sarkoidoz hastalarında periferik kanda lenfopeni vardır. Tüberkülin ve diğer cilt testlerine kütanöz anerji söz konusudur. Sağlıklı insanlardaki bronkoalveoler lavaj (BAL) örneğindeki 2:1 olan CD4+/CD8+ hücre oranı sarkoidozda 3.5:1’den yüksek saptanmaktadır.
Akciğerdeki T hücrelerinden interlökin 2 reseptör (IL-2R veya CD25), CD26, CD69 gibi aktivasyon belirteçlerinin ekspresyonunda artış görülür. Aktive olan T hücreleri güçlü yardımcı T (T helper, TH) sitokinlerinden olan interlökin 2 (IL-2) ve interferon gama (IFN-g) üretirler.
T hücrelerinin aktive olması için MHC-antijen kompleksi veya lokal sitokin ortamına maruziyet gerekir. Antijen sunucu hücreler olarak bilinen makrofajlar veya dendritik hücreler antijeni hücre içerisine alarak küçük parçalara ayırırlar. MHC moleküllerinin peptit bağlantı bölgesine eklerler. T hücre uyarılması bu şekilde başlamış olur. T hücre reseptörünün değişken (variable, V) kısmı MHC-antijen kompleksine bağlanır. Antijenik uyarımın olduğu bölgede V-a veya V-b T hücre reseptörünü eksprese eden spesifik T hücre populasyonu artar. T hücrelerinin etkili biçimde uyarılmasında antijen sunan hücreler üzerindeki CD80 ve CD86 ile CD28 arasındaki etkileşimin olduğu düşünülmektedir.[6]
Sarkoidoz hastalarında natural killer T (NKT) hücrelerinin Löfgren sendromu olmayanlarda sayısının periferik kanda azaldığı gösterilmiştir. Bu hücreler mediastinal lenf nodlarında ve granülomatöz lezyonlarda yoktur. Akciğerde oranı artmamıştır.[7] CD3+ CD4+CD25+FOXP3+ T hücrelerinin sayısı aktif sarkoidoz hastalarında artmıştır.[8] Diğer bir düzenleyici T hücre alt tipi CD4+ olan sitotoksik T lenfosit ilişkili protein 4 (CTLA-4) eksprese eder. CD80/CD86 ligandı için CD28 ile yarışa girer ve immün cevaplarda azalmaya neden olur.
Sarkoid enflamasyonda monosit ve makrofajlar birikmektedir. Toplanan monositler granülom oluşumunda yer almakta ve epiteloid hücreleri oluşturmaktadır. Sarkoidoz hastalarının kanında monositler aktivedir. Yüksek oranda lizozim salgılarlar.[9,10] Alveoler makrofajlarda daha fazla CD11c, HLA sınıf II, adezyon molekülü CD54 (ICAM 1) ve eş stimülatör moleküller olan CD80, CD86 eksprese iken monositlerde daha yüksek CD11a, CD11b integrinleri ile CD14 (LPS reseptörü) eksprese edilmektedir.[11]
Aktif sarkoidoz hastalarında BAL’daki alveoler makrofajlarda IL-15 eksprese ve sekrete edilmektedir.
IL-15, IL-2 reseptör kompleksine bağlanarak CD4+ T hücrelerdeki proliferatif cevapları arttırmaktadır.[12] BAL alveoler makrofajları IL-1 ve tümör nekroze edici faktör alfa (TNF-a) sekrete etmektedir. Bu nedenle anti-TNF tedavisi önem kazanmaktadır.
IL-12 ve IL-18 makrofajlara tarafından salgılanan ve Th1 sarkoid immün cevaplarda rol alan sitokinlerdir. IFN-g sekresyonunu arttırırlar. Ciltteki sarkoid granülomlarda IFN-g, P21 (Waf1) ekspresyonu üzerinden makrofajlardaki apoptozisi inhibe etmektedir.[13]
Monositler ve doku makrofajları sarkoidozlu hastalarda apoptozise dirençlidir. Akciğerde hücre toplanması ve granülom oluşumunda etkili olan sitokin ve kemokinleri salgılarlar. Makrofaj ve T hücre etkileşimi hastalığın ilerlemesine neden olur. Onarım ve fibrozisin evresini belirler. Oluşacak fibrozis ve skar fibroblastların toplanmasına ve hücredışı matriks proteinlerini üretmelerine bağlıdır. Kişinin yatkınlığına bağlı olarak sitokin dengesinde meydana gelebilecek istenmeyen bir etki akciğerlerde fibrozis ile sonuçlanır.[14]
Sarkoidozdaki granülom oluşumu üzerine hayvan modelleri ile çalışmalar yürütülmektedir. Osteopontin üretemeyen fare modeli ile yapılan çalışmada granülomların iyi oluşamadığı ve yaygın BCG enfeksiyonunun geliştiği gösterilmiştir.[15] Schistosoma hipersensitivite akciğer granülomu modelinde osteopontin üretemeyen farelerde daha az makrofaj ve epiteloid hücre toplanmıştır.[16] Farelerde ayrıca Mycobacterium tuberculosis yüzey glikolipidi olan kord faktörü ile oluşturulan yabancı cisim ve hipersensitivite tipi granülom oluşturulmuştur.[17] Sarkoidozdaki granülom modellerinde en çok çalışılan patojenler Propionibacterium ve Mycobacterium’dur. Kweim ajanı ile yapılan hayvan model çalışmaları ile de granülomdaki enflamasyon mekanizmaları aydınlatılmaya çalışılmaktadır.
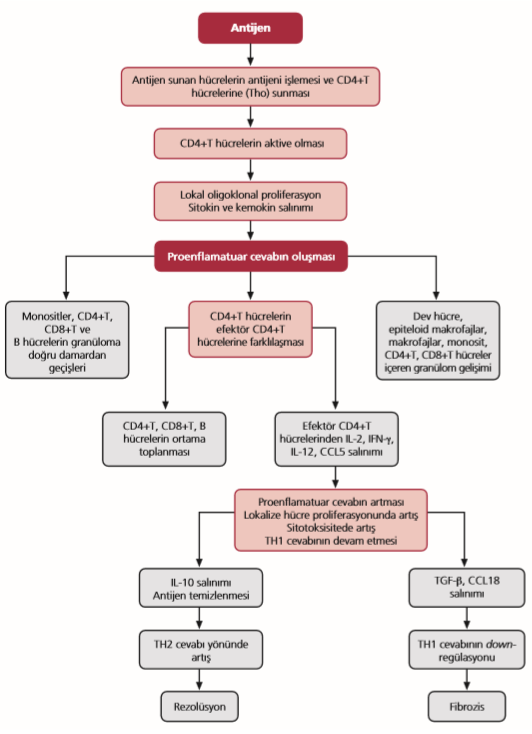
Sarkoidoz hastalığının immünopatolojisi üzerine hipotetik modeller de oluşturulmuştur (Şekil 1.1). Sarkoidozda granülom oluşumu antijen sunan hücreler, antijen ve T hücreler arasındaki etkileşim neticesinde ortaya çıkar. Granülom oluşumunun başlangıç safhasında makrofajlar aktive olduktan sonra ağırlıklı olarak monositler ve CD4+ T hücreleri toplanmaktadır. Antijen veya patojenin etrafında duvar oluşturulmaya çalışılır. Kemokinler aracılığı ile enflamatuar hücreler gelir. Efektör fazda enflamasyon bölgesinde spesifik hücreler toplanır. Sarkoidoz vakalarında CD4+ T hücreleri çoğunluktadır. Transforme edici büyüme faktörü beta (Transforming growth factor beta, TGF-b ve IL-10 gibi düzenleyici sitokinler TNF-a, IFN-g gibi proenflamatuar sitokinleri dengede tutarlar ise lokal doku seviyesinde rezolüsyon meydana gelir. TGF-b’daki lokal artış fibrozisi oluşturur.[18]
Sonuç olarak, sarkoidoz immünopatogenezinde mevcut bilgilerimiz sınırlıdır. Hastalıkta bazı sıralı immünolojik olayların sonucunda granülom oluşmaktadır. Maalesef bazı durumlarda fibrozis gelişmektedir. Sırası ile antijen maruziyeti, alveoler makrofajların aktive olması, antijen işlenmesi ve sunumu sonrası edinilmiş T hücre cevabının oluşması, spesifik efektör T hücrelerin ortaya çıkması, granülomun meydana gelmesi ve bazı durumlarda fibrozis gerçekleşmektedir. Önümüzdeki yıllarda da sarkoidoz bilinmeyenler hastalığı olarak araştırmalara konu olmaya devam edecek görülmektedir.
Kaynaklar
- Grutters JC, Drent M, van Den Bosch JMM. Sarcoidosis. European Respiratory Monograph 2009;46:126-54.
- Rybicki BA, Walewski JL, Maliarik MJ, Kian H, Iannuzzi MC. The BTNL2 gene and sarcoidosis susceptibility in African Americans and whites. Am J Hum Genet 2005;77:491-9.
- Valentonyte R, Hampe J, Huse K, et al. Sarcoidosis is associated with a truncating splice site mutation in BTNL2. Nat Genet 2005;37: 357-64.
- Song Z, Marzilli L, Greenlee BM, et al. Mycobacterial catalaseperoxidase is a tissue antigen and target of the adaptive immune response in systemic sarcoidosis. J Exp Med 2005;201:755-67.
- Rossman MD, Thompson B, Frederick M, et al. HLA and environmental interactions in sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2008;25: 125-32.
- Noor A, Knox KS. Immunopathogenesis of sarcoidosis. Clin Dermatol 2007;25:250-8.
- Ho LP, Urban BC, Thickett DR, Davies RJ, McMichael AJ. Deficiency of a subset of T-cells with immunoregulatory properties in sarcoidosis. Lancet 2005;365:1062-72.
- Miyara M, Amoura Z, Parizot C, et al. The immune paradox of sarcoidosis and regulatory T cells. J Exp Med 2006;203:359-70.
- Gee JB, Bodel PT, Zorn SK, Hinman LM, Stevens CA, Matthay RA. Sarcoidosis and mononuclear phagocytes. Lung 1978;155:243-53.
- Prior C, Barbee RA, Evans PM, et al. Lavage versus serum measurements of lysozyme, angiotensin converting enzyme and other inflammatory markers in pulmonary sarcoidosis. Eur Respir J 1990;3:1146-54.
- Wahlstrom J, Berlin M, Skold CM, Wigzell H, Eklund A, Grunewald J. Phenotypic analysis of lymphocytes and monocytes/macrophages in peripheral blood and bronchoalveolar lavage fluid from patients with pulmonary sarcoidosis. Thorax 1999;54:339-46.
- Agostini C, Trentin L, Facco M, et al. Role of IL-15, IL-2, and their receptors in the development of T cell alveolitis in pulmonary sarcoidosis. J Immunol 1996;157:910-8.
- Xaus J, Besalduch N, Comalada M, et al. High expression of p21Waf1 in sarcoid granulomas: a putative role for long-lasting inflammation. J Leukoc Biol 2003;74:295-301.
- Agostini C, Facco M, Chilosi M, Semenzato G. Alveolar macrophage-T cell interactions during Th1-type sarcoid inflammation. Microsc Res Tech 2001;53:278-87.
- Nau GJ, Liaw L, Chupp GL, Berman JS, Hogan BL, Young RA. Attenuated host resistance against Mycobacterium bovis BCG infection in mice lacking osteopontin. Infect Immun 1999;67: 4223-30.
- O’Regan AW, Hayden JM, Body S, et al. Abnormal pulmonary granuloma formation in osteopontin-deficient mice. Am J Respir Crit Care Med 2001;164:2243-7.
- Yamagami H, Matsumoto T, Fujiwara N, et al. Trehalose 6,6’-dimycolate (cord factor) of Mycobacterium tuberculosis induces foreign-body- and hypersensitivity-type granulomas in mice. Infect Immun 2001;69:810-5.
- Iannuzzi MC, Fontana JR. Sarcoidosis: clinical presentation, immunopathogenesis, and therapeutics. JAMA 2011;26;305:391-9.
