Sarkoidoz nedeni bilinmeyen, multisistemik granülomatöz bir hastalıktır. En sık akciğerleri ve intratorasik lenf nodlarını tutar. Akciğer dışı sarkoidozda en sık tutulan yerler cilt, göz, retiküloendoteliyal sistem, kas ve iskelet sistemi, ekzokrin glandlar, kalp ve sinir sistemidir.
Sarkoidoz tanısı, uyumlu klinik ve radyolojik görünümlerle birlikte, histopatolojik olarak kazeifikasyon nekrozu içermeyen epiteloid hücreli granülomların gösterilmesi ve aynı tabloya yol açabilecek diğer klinik durumların, granülom nedenlerinin ve lokal sarkoid reaksiyonlarının ekarte edilmesi ve en az iki organda tutulumun gösterilmesi ile konur.[1,2] Tanıda histopatoloji önemlidir ama her zaman gerekli olmadığı gibi yeterli de değildir. Çünkü tüberküloz, atipik mikobakteri ve mantar enfeksiyonları başta olmak üzere pek çok enfeksiyon etkeni, berilyum, titanyum gibi metallere maruziyet, ilaç reaksiyonları, yabancı cisim aspirasyonu granülom oluşturur; hipersensitivite pnömonisinde, Wegener granülomatozisinde, kanser ve lenfomalara reaksiyon olarak granülom gelişebilir. Bazı nadir spesifik durumlarda, başvuru klinik ve radyolojik bulgular sarkoidoz için o kadar tipiktir ki doku biyopsisi olmadan da tanı konabilir.
Doku biyopsisi olmadan sarkoidoz olarak kabul edilebilen, spesifik klinik başvuru bulguları şunlardır.[2]
- Löfgren sendromu (akciğer radyografisinde bilateral hiler adenopati, eritema nodosum cilt lezyonları, sıklıkla ateş, sıklıkla ayak bileğinde artralji/artrit).
- Heerfordt sendromu (üveit, bilateral parotid, sıklıkla ateş, fasial sinir felci).
- Semptomsuz hastada akciğer radyografisinde bilaterax l hiler adenopati olması.
- Galyum-67 sintigrafisinde panda (parotis ve lakrimal bez tutulumu) ve lambda (bilateral hiler ve sağ paratrakeal lenf nodu tutulumu) bulgusu.[2,3] Bu durumlarda bile klinisyen hastanın sarkoidoz olduğunu kabul etmeden önce alternatif tanıları genellikle ekarte etmelidir (örn. akciğer grafisinde bilateral hiler lenfadenopati ve eritema nodosum cilt lezyonu olan Löfgren sendromunda koksidiomikozis ekarte edilmelidir).[2]
Sarkoidozun doğru tanısı için klinik, radyolojik ve histopatolojik bulguları birlikte değerlendiren yaklaşım önerilmektedir.
Sarkoidozlu bir hastanın ilk değerlendirilmesinde önerilen testler şunlardır:[1,4,5]
- Öykü (meslek ve çevresel maruziyet, semptomlar)
- Fizik muayene
- Posteroanterior akciğer grafisi
- Pulmoner fonksiyon testleri [vital kapasite, 1. saniyede zorlu ekspiratuvar volüm (FEV1), karbon monoksit diffüzyon kapasitesi (DLCO)]
- Periferik kan sayımları: Lökosit, eritrosit, trombosit
- Serum biyokimya tetkikleri [kalsiyum, karaciğer enzimleri, üre, kreatinin, anjiotensin-konverting enzim (ACE)]
- İdrar analizleri, 24 saatlik idrar kalsiyumu
- Elektrokardiyografi
- Rutin göz muayenesi
- Tüberkülin cilt testi (TCT)
- Fiberoptik bronkoskopi ile mukoza ve transbronşiyal biyopsi, bronkoalveoler lavajla (BAL) CD4/CD8 oranı
- Endobronşiyal ultrasonografi rehberliğinde transbronşiyal iğne aspirasyonu (EBUS-TBİA)
Son zamanlarda pozitron emisyon tomografi (PET), kardiyak manyetik rezonans görüntüleme (MRG) ve gelecekte tanısal değeri olabilecek genetik gibi minimal invaziv işlemlerde gelişmeler mevcut olup bu tetkikler de sardoidozun tanı yöntemleri olarak kullanılmaktadır.[4,6]
Klinik Değerlendirme
Sarkoidoz hiçbir yakınması olmayan bir hastada rastlantıyla çekilen akciğer grafisinde saptanabileceği gibi, konstitüsyonel belirtiler veya tutulan organ sistemine ait belirtilerle de ortaya çıkabilir. Tanı sırasında sarkoidozlu hastaların %30-50’si asemptomatiktir.[4] Semptomlar genellikle nonspesifik olduğu için tanı gecikmelerine yol açar. Ateş, halsizlik, iskelet kası güçsüzlüğü, kilo kaybı (son 10-12 hafta içerisinde 2-6 kg), gece terlemesi, artralji hastaların yaklaşık %20-30’unda bulunabilir. Sarkoidoz nedeni bilinmeyen ateşin önemli ve genellikle gözden kaçan bir nedenidir. En sık tutulum bölgesi akciğerler olduğu için olguların üçte biri veya yarısında solunum sistemine ilişkin belirtiler bulunur. En sık görülen solunumsal belirtiler nefes darlığı, öksürük ve göğüs ağrısıdır.[4,7,9]
Bazı demografik ve klinik özellikler, patognomik olmasa da, sarkoidoz tanısını destekler. Sarkoidoz genellikle 40 yaş altında görülür ve 20-29 yaşlar arasında pik yapar. Kadınlarda 50 yaşın üzerinde daha küçük ikinci bir pik izlenir. 18 yaşın altında ve 50 yaşın üzerindeki erkeklerde sarkoidoz olasılığı azalır. Afrikalı Amerikalılar’da ve Kuzey Avrupalılar’da yüksek prevalans izlenir. Akciğer radyografisinde lezyonlar görülmesine karşın hastanın asemptomatik olması, sigara içme öyküsü olmaması (sarkoidoz daha çok sigara içmeyenlerde görülür), aile öyküsü olması (sarkoidozlu hastaların birinci derece akrabalarında sarkoidoz prevalans hızı genel popülasyonda bulunandan daha yüksektir) sarkoidoz olasılığını destekler. Tüberküloz, organik biyoaerosol, berilyum maruziyeti ve intravenöz ilaç alışkanlığı ise sarkoidoz olasılığını azaltır.[2,10]
Sarkoidoz multisistem tutulumlu bir hastalık olduğu için dikkatli sistemik inceleme ve fizik muayene yapılmalıdır. En sık tutulan bölge bilateral hiler lenfadenopati ve pulmoner infiltrasyon görünümüyle akciğerlerdir (%95) . Bunu cilt, lenf nodu, göz ve karaciğer tutulumu izler.[8] İki veya daha çok organ sistemi tutulumu sarkoidoz tanısını destekler. Bu yüzden pulmoner hastalıkla birlikte bu organlardan birinde eşlik eden hastalık olması sarkoidozu akla getirmelidir (akciğer ve göz tutulumu gibi). İlk organda biyopsi ile histolojik olarak nonkazeifiye granülomatöz enflamasyon kanıtlandığında, ikinci organın sarkoidoz için kabul edilebilir klinik kriterleri varsa, ikinci organın histolojik kanıtı gerekmez. Örneğin, sadece karaciğerde nonkazeifiye granülomların bulunması sarkoidoz tanısı için yetersizdir ancak akciğer grafisinde eşlik eden bilateral hiler adenopatinin bulunması sarkoidozun ikinci organ tutulumu için yeterli kanıt olduğu düşünülür. Bu yüzden hiler lenf nodu veya akciğer biyopsisi gerekli değildir.[11]
Başlangıç bulgularına göre klinik olarak sarkoidoz iki tiptir. Akut sarkoidozda başlangıç anidir. Bilateral hiler lenfadenopati, ateş, eritema nodozum, ayak bileği artriti (klasik Löfgren sendromu) ile karakterizedir. Akut hastalıkta ayrıca veziküler veya makulopapüler raş, akut iritis, konjonktivit, akut granülomatöz kardiyak tutulumda aritmi görülür. Prognoz iyidir ve spontan remisyon genellikle iki yıl içinde olur. Kronik sarkoidoz sinsi başlangıçlıdır. Lupus pernio, kronik üveit, kronik hiperkalsemi, nefrokalsinozis, başlangıç yaşının daha ileri olması, siyah ırk, progresif pulmoner sarkoidoz, nazal mukoza tutulumu, kistik kemik lezyonları, nörosarkoidoz kronik ve progresif seyirle ilişkilidir.[12]
Solunum Fonksiyon Testi
Solunum fonksiyon testleri sarkoidozlu çoğu hastada anormaldir fakat tanısal patern yoktur. Akciğer radyografisinde parankimi normal olan hastalarda, vital kapasite, diffüzyon kapasitesi, istirahatte ve egzersizde PaO2 ve akciğer kompliansı olguların %20-40’ında, akciğer parankimi tutulumunda ise olguların %50-70’inde solunum fonksiyon testi bozukluğu vardır.[13] Genellikle restriktif fonksiyon bozukluğu görülür. Vital kapasite ve DLCO azalır. Hastaların bir kısmında hava akımı obstrüksiyonu bulunur. Hava akımı obstrüksiyonu endobronşiyal tutulum veya stenoza ya da parankim hastalığı sonucu gelişen hava yolu distorsiyonuna bağlıdır. Olguların bir kısmında bronş hiperreaktivitesi gelişir. Diffüzyon kapasitesinin azalması sadece restriktif hastalıkla değil ayrıca sarkoidoza bağlı pulmoner hipertansiyonla da ilişkili olabilir. En ciddi solunum fonksiyon bozukluğu evre IV fibrokistik hastalığı olan hastalarda görülür. Solunum fonksiyon testi hastanın klinik seyrini izlemede önemlidir. 6 dakika yürüme testi olguların çoğunda azalır.[14]
Laboratuvar Bulguları
Çeşitli laboratuvar anormallikleri sarkoidozlu hastalarda sıklıkla görülebilir:
- Anemi nadirdir. Genellikle kronik hastalık anemisinden kaynaklanır, ancak bazı hastalarda hipersplenizm, kemik iliği tutulumu veya otoimmün hemolitik anemi ortaya çıkabilir.[15]
- Lökopeni (%5-10), eozinofili (yaklaşık %25) ve trombositopeni (nadir) görülebilir.
- Eritrosit sedimantasyon hızı sıklıkla yüksektir, fakat hastalık aktivitesini değerlendirilmesinde faydalı değildir.
- Hiperkalsiüri hiperkalsemiden (%2-10) 3 kat daha sık görülür. Bu anormallikler aktive olmuş makrofaj ve granülomlardan 1,25-(OH)2-D3’ün (kalsitriol) anormal üretilmesine bağlıdır.[16] Tanı konulamayan kalıcı hiperkalsemi ve hiperkalsiüri nefrokalsinozise ve böbrek yetmezliğine neden olabilir. Bu nedenle sarkoidoz tanısı konan tüm hastalara kan kalsiyumu ve 24 saatlik idrar kalsiyumu bakılmalıdır.
- Hipergammaglobulinemi ve romatoid faktör pozitifliği saptanabilir.
- Serum alkalen fosfatazda orta derecede artış diffüz granülomatöz karaciğer tutulumunu gösterir. Karaciğer fonksiyon testleri normalin üç katından fazla olur.
- Kreatinin fosfokinaz/aldolaz artışı kas tutulumunu gösterir.
- TCT hastaların yaklaşık %85’inde negatiftir.
- Kveim-Siltzbach testi insan sarkoid dokusunun intradermal enjeksiyonu ile yapılır. Dört hafta sonra enjeksiyon bölgesinde oluşan papülden biyopsi alınır. Histopatolojik açıdan bu papül nonkazeifiye granülomatöz bir enflamasyondur. Geçen 50 yılda 10,000’den fazla bu testi uygulayan bir tıp merkezi gerçek pozitif sonuçların %50 ve yanlış negatif sonuçların sıfıra yakın olduğunu bildirdiler. Ticari bulunabilirliğinin olmaması, insan dokusu kullanımındaki kısıtlılıklar ve her yeni preparasyonun in vivo doğrulanması gerektiği için testin kullanımı çok sınırlıdır.[17] Bu yüzden sarkoidozun standart tanısal testi değildir.
- Kan gazı normal olabilir veya hipoksemi ve hipokapni (hiperventilasyon) görülebilir.
- Serum ACE (sACE) seviyeleri tedavi edilmemiş sarkoidozlu hastaların %75’inde yükselmiştir.[18] Serum ACE sarkoid granülomlarının epiteloid hücrelerinde üretilir ve sACE seviyeleri sarkoidozda total granülom yükünü yansıtır. Başlangıçta yükselmiş sACE seviyelerinin sarkoidoz için tanısal olduğu düşünülmüşse de, hastalığın tanısı için yeteri kadar sensitif ve spesifik değildir. Bin dokuz yüz kırk bir sarkoidozlu, 1,575 sağlıklı kontrol ve 1,355 diğer hastalığı olan hastalardan oluşan bir çalışmada, sarkoidoz tanısı için artmış sACE’nin sensitivitesi %57, spesifitesi %90, pozitif prediktif değeri %90 ve negatif prediktif değeri %60 olarak bulunmuştur.[19] Bu yüzden, sarkoidoz tanısında tarama amaçlı kullanımda yeteri kadar sensitif değildir. Ayrıca, artmış sACE tanı için oldukça spesifik olsa da, sarkoidoz tanısını teyit etmek için halen yeteri kadar spesifik değildir. Dissemine tüberküloz, fungal enfeksiyon, hipertiroidizm, Gaucher hastalığı, diabetes mellitus, siroz, osteoartrit, kronik berilyozis, silikozis ve Hodgkin lenfoması olan hastalarda sACE artabilir.[4] Kortikosteroid veya ACE inhibitörü kullanımı sACE seviyesini baskılar. Plazma ACE seviyesini etkileyebilen ve bireyler arasında büyük değişkenlik ile sonuçlanabilen, ACE geninde intron 16’da insersiyon/delesyon polimorfizimini de içeren birkaç allelik polimorfizm tanımlanmıştır.[20] Serum ACE için genotipe göre düzeltilmiş referans değerler yayınlanmıştır. Genotip ile düzeltilmiş ACE seviyelerini kullanmanın daha duyarlı ve kullanışlı bir tanısal araç olabileceği ileri sürülmektedir.[21] ACE seviyesi hastalığın seyrini takipte kullanılabilir, ancak ACE seviyesi hastalığın ciddiyeti ile her zaman korele değildir.[22]
- Lizozim makrofajlar tarafından üretilir. Sarkoidozlu hastaların üçte ikisinde serum lizozimi yükselmiştir. Hastalığın yaygınlık ve aktivitesi ile doğru orantılıdır. Serum lizoziminin spesifitesinin sACE’den daha düşük olduğu bildirilmiştir. Tüberküloz, silikozis, asbestozis, berilyozis gibi hastalıklarda da yüksek değerler saptanmıştır.[23]
- TNF-a sarkoidozun patogenezinde kilit rol oynar. Solubl TNF reseptör II (sTNFRII) serum konsantrasyonları sarkoidozlu hastalarda artar ve daha yüksek sTNFRII seviyeleri daha ileri radyolojik evre ve hastalığın ilerlemesi ile koreledir.[24] IL-18, IL-12 p40, YKL-40’ın serum konsantrasyonları sarkoidozda yüksek bulunmuştur.[4]
Radyolojik De¤erlendirme
Pulmoner sarkoidozlu hastaları değerlendirmek için akciğer radyografisi en sık kullanılan radyolojik görüntüleme tekniğidir. Çünkü sarkoidoz herhangi bir organı tutabilse de, hastaların %90’ında akciğer tutulumu görülür. Sarkoidozda akciğer radyografisine göre evreleme yapılmaktadır. Evre 0: Normal akciğer grafisi görünümü (%5-10) ve sıklıkla ekstrapulmoner bulgularla birliktedir. Evre I: Bilateral hiler lenfadenopati (%40); evre II: Bilateral hiler lenfadenopati ve parankimal infiltratlar (%30-50); evre III: Sadece parankimal infiltratlar (%15); evre IV: Fibrozis şeklinde sıralanır (Resim 3.1).[25]
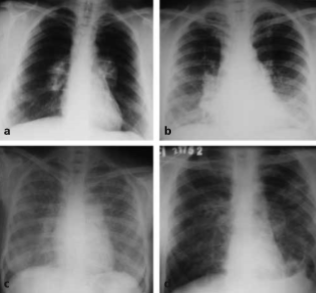
Resim 3.1: Sarkoidoz tanısı konmufl hastaların PA akciğer grafileri. (a) Evre I: Bilateral hiler lenfadenopati. (b) Evre II: Bilateral hiler lenfadenopati+parankimal mikronodüller. (c) Evre III: Parankimal infiltrasyonlar. (d) Evre IV: Fibrozis, apikal büller, kistik alanlar izleniyor.
Bilateral hiler lenfadenopatiye sıklıkla sağ paratrakeal lenf nodu genişlemesi eşlik eder. Hiler lenfadenopati simetrik ve iyi sınırlıdır. Hilus ile mediastinal kontur arasında ince bir bant şeklinde akciğer parankimi seçilmesi lenfoma ile ayırıcı tanıda önemlidir. Uzun süren hastalıkta kalsifikasyon da görülebilir. Pulmoner infiltratlar özellikle üst ve orta zonlarda, perihiler bölgede olup retikülonodüler, ince lineer kimi zaman da ayrı nodüller ve alveoler konsolidasyon şeklindedir. Milier patern de görülebilir. Fibrozisin geliştiği evre IV’de üst akciğer alanlarında hiluslarda çekilme ile birlikte, volüm kaybı, kaba fibröz bantlar, bronşektazili konglomera kitleler, küçük ve büyük büller, kistik değişiklikler ve bal peteği izlenir. Sarkoidozda nadir olarak akciğer grafisinde pnömotoraks, miçetoma, izole nodül veya kitle, lober atelektazi veya plevral effüzyon görülebilir.[25] Sadece klinik ve/veya radyolojik görünümler evre I (güvenilirliği %98) veya evre II (%89) hastalarda tanısal olabilir, fakat evre III (%52) veya evre 0 (%23) hastalığı olan hastalar için doğrusal tanılığı daha azdır.[26] Asemptomatik, simetrik bilateral hiler lenfadenopatisi olan hastalara sarkoidoz tanısı için histopatolojik doğrulama gerekli değildir. Buna karşın lenfadenopati asimetrikse, belirgin progresyon gösteriyorsa veya paratrakeal tutulum büyükse histopatolojik doğrulama yapılmalıdır.[4,27]
Yüksek rezolüsyonlu bilgisayarlı tomografi (YRBT) bulguları, sarkoidoz tanısı için, akciğer radyografisinden daha fazla spesifiktir.[2] Düz akciğer grafisinde görülmeyen parankimal lezyonlar tespit edilebilir. Parankimal lezyonlar nodüler, retiküler veya buzlu cam görünümünde olabilir.
Sarkoidozda başlıca YRBT bulguları şunlardır:[28]
- Düzgün veya nodüler peribronkovasküler interstisyel kalınlaşma (peribronşiyal kılıflanma)
- Plevral yüzeyler, interlobüler septa, sentrilobüler yapılarla ilişkili, küçük iyi sınırlı 2-10 mm nodüller
- Nodüllerin akciğerlerin santral bölgeleri ve üst lob peribronkovasküler dağılımı
- Bir santimetreden büyük nodüller ve konsolidasyon
- Fibrozis bulguları: Septal kalınlaşma, traksiyon bronşektazisi, bal peteği
- Bronşektazinin eşlik ettiği konglomera kitleler
- Buzlu cam görünümü
- Simetrik lenf bezi genişlemesi
Yüksek rezolüsyonlu bilgisayarlı tomografide 2-10 milimetrik nodüllerin bronkovasküler demetler boyunca ve subplevral dağılım (perilenfatik dağılım) göstermesi sarkoidoz olasılığını destekler (Resim 3.2).[2]
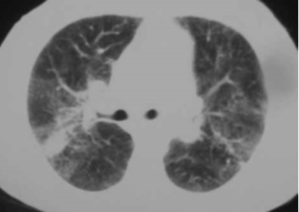
Resim 3.2: Sarkoidozlu bir hastanın toraks bilgisayarlı tomografi görünümü
Yüksek rezolüsyonlu bilgisayarlı tomografi bulguları histolojik anormallikler ile korelasyon gösterebilir. Örneğin buzlu cam görünümleri sarkoid granülomları ile ilişkilidir. Bilgisayarlı toraks tomografisinin rutin olarak kullanımı gerekli değildir. Atipik klinik ve/veya akciğer grafi bulguları, tipik radyolojik bulgular olmaksızın sarkoidoz için yüksek klinik şüphe, ve traksiyon bronşektazisi, aspergilloma, pulmoner fibrozis, amfizem gibi akciğer hastalığının komplikasyonları veya eşlik eden enfeksiyon ve malignitenin varlığında YRBT endikasyonu vardır.[26] Bu durumlar hastaların yaklaşık %30’unda görülür.[4]
Galyum-67 sintigrafisi tüm vücutta enflamasyonun saptanmasında yararlıdır. Lamda (bilateral hiler ve sağ paratrakeal lenf nodu tutulumu) ve panda (parotis, lakrimal gland tutulumu) görünümü sarkoidoz için patognomiktir (Resim 3.3).
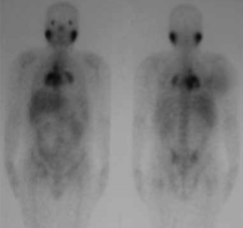
Resim 3.3: 37 yaşında sarkoidoz tanılı erkek hastanın galyum-67 tüm vücut sintigrafisinde her iki lakrimal ve parotis glandında simetrik, yoğun artmş aktivite tutulumları (panda belirtisi), mediastinal ve bilateral hiler lenf nodlarında artmş aktivite tutulumları izleniyor.
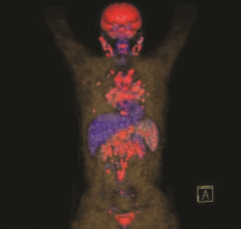
Resim 3.4: PET imajlar›ndan elde edilmifl 3-B rekonstrüksiyon görüntüsü. Sarkoidoz tanısı alan hastada çok sayıdaki servikal, mediastinal ve abdominal LAP’larda izlenen FDG tutulumu. Ayrıca akciğer parankimindeki nodüler lezyonlarda da FDG tutulumu mevcut (Dr. Atila Gökçek ve Dr. Özlem Özmen arflivi. Değerli izinleri ile kullanılmıştır).
Bu görünümler sarkoidoz tanısını destekler ve invaziv tanısal işlemleri önler. Diğer paternler sarkoidoz için spesifik değildir.[4,7,26] Bazı interstisyel akciğer hastalıklarında, enfeksiyonlarda ve malignitelerde de gözlendiği için özgüllüğü düşüktür. Birkaç aylık sistemik kortikosteroid tedavisi, transferrin reseptörlerinde hızlıca azalmaya yol açacağından, yanlış negatif galyum taramalarına neden olur.
18F-florodeoksiglukoz pozitron emisyon tomografisi (FDG-PET) sistemik enflamatuar aktiviteleri değerlendirmede değerlidir ve özellikle ekstrapulmoner tutulumu saptanmasında galyum taramasından daha sensitiftir.[29] Aktif sarkoid granülomatöz alanlarını saptamadaki sensitivitesi %80-100’e ulaşır. Teirstein ve ark.,[30] FDG-PET taramanın, sarkoidozlu hastalarda gizli tanısal biyopsi alanlarını saptamada değerli olduğunu göstermişlerdir. Ayrıca FDG-PET’de pozitif tutulumun, radyolojik evresi II ve III olan sarkoidoz hastalarının 2/3’ünde olabileceğini buna karşın, FDG-PET’de negatif tutulumun evre 0, I ve IV sarkoidoz hastalarında yaygın olduğunu da göstermişleridr. FDG-PET’de yanlış pozitif tutulumun diğer granülomatöz hastalıklar, enfeksiyon ve neoplazili hastalarda da gözlenmesi FDG-PET’in kullanımını sınırlar. L-[3-18F]-a-metil tirosin (18F-FMT) bir amino asit analoğudur. Amino asit transport sistemi aracılıyla sadece tümör hücrelerinde birikir. 18F-FDG ile kıyaslandığında maligniteyi değerlendirmede daha spesifiktir. Yirmi dört sarkoidozlu hastayı içeren bir çalışmada, FMT-PET, FDG-PET ile kombine kullanıldığında, sarkoidozu maligniteden ayırmada değerli olabileceği gösterilmiştir.[31] Akciğer kanserinde FDG-PET ile artmış tutulum hastaların %94’ünde, FMT-PET ile hastaların %88’inde görülürken, sarkoidozlu lezyonlar sadece FDG-PET’de pozitif ve FMT-PET’de her zaman negatif bulunmuştur. PET taramaları sarkoidozun tanısal değerlendirilmesinde rutin olarak uygulanmaz. Ancak PET taramaları potansiyel biyopsi alanlarını göstererek ve göreceli olarak ulaşılamayan organlarda (kalp ve beyin gibi) hastalığı saptayarak sarkoidoz tanısında yararlı olabilir (Resim 3.4).[3]
Kardiyak sarkoidoz yaşamı tehdit eder ve endomiyokardiyal biyopsi tanıda altın standart olsa da hastaların 1/4’ünden azında tanıyı destekler. Kardiyak sarkoidoz tanısında PET tarama önemlidir. MRG’nin kontrendike olduğu pacemaker veya defibrilatörlü hastalarda da uygulanabilir.[3] Bir çalışmada, sarkoidozlu hastalarda infliksimab tedavisi sırasında FDG-PET görüntülemesindeki değişikliklerin klinik düzelme bulguları ile korelasyon gösterdiği bulunmuştur. Bu bulgu FDG tutulumunun hastalık aktivitesini yansıttığı hipotezini desteklemektedir.[32]
Ekokardiyografi, sarkoidozun yaşamı tehdit eden bir komplikasyonu olan pulmoner hipertansiyonu saptamada yararlı noninvaziv bir tanı aracıdır. Sonuçları sağ kalp kataterizasyonu ile koreledir.[4] Ekokardiyografi ile sarkoidozun kalp tutulumu da değerlendirilir.
Kardiyak MRG’nin kardiyak sarkoidoz tanısında, standard kardiyak değerlendirmeye ek değeri olduğu gösterilmiştir. Kardiyak MRG, kardiyak sarkoidoz tanısında, ekokardiyografi, talyum ve galyum sintigrafisinden daha sensitif ve spesifiktir; kardiyak tutulumun erken saptanmasında önemlidir.[33] Kardiyak tutulum tanısı için FDG-PET ve kardiyak MRG’nin sensitivite ve spesifitesinin araştırıldığı bir çalışmada, FDG-PET için sensitivite %88, spesifite sadece %39 bulunurken, kardiyak MRG için bu değerler sırasıyla %75 ve %77 olarak bulunmuştur.
Pozitif FDG-PET bulguları ile yükselmiş sACE seviyeleri arasında pozitif bir korelasyon olduğu da gösterilmiştir. Sonuç olarak, kardiyak MRG, sarkoidozun kardiyak tutulumunu değerlendirmek için kullanılması önerilen noninvaziv, radyoaktif olmayan bir tanı yöntemidir.[4]
Nörosarkoidozun tanısında gadolinyumlu beyin MRG, elektromiyografi (EMG), serebrospinal sıvı analizi (lenfosit, protein, ACE seviyelerinde artma, CD4/CD8 >5); karaciğer, dalak tutulumunu araştırmak için de ultrasonografi ve bilgisayarlı tomografi gibi tanı yöntemleri kullanılır.
Bronkoalveoler Lavaj
Bronkoalveoler lavaj güvenli, minimal invaziv, bir tanı yöntemidir ve sarkoidoz tanısında yararlı bilgi sağlar. Sarkoidoz için BAL’ın karakteristik bulgusu, normal veya lenfositlerin sayı ve yüzdesinin arttığı, genellikle eozinofil ve nötrofillerin normal oranda olduğu, plazma hücresi ve köpüksü alveoler makrofajların olmadığı hafifce artmış total hücre sayımıdır.[4,6,35] Tanı anında sarkoidozun evresinden bağımsız olarak hastaların %90’ında lenfositlerde artış bulunabilir. BAL sıvısında lenfositlerin %15’in üzerinde olmasının sensitivitesi %90’dan fazladır, fakat spesifitesi düşüktür. BAL sıvısı hastaların %10-15’inde normal olabilir. Aktif hastalıklı hastalarda inaktif sarkoidoza göre lenfosit sayısı daha yüksektir. Geç veya ileri sarkoidozda, nötrofiller (totalin %3’ünden fazla) ve mast hücreleri (%1’den fazla) de artabilir. Yeni tanı almış sarkoidozlu hastanın BAL sıvısında nötrofillerin artması kötü prognozu gösterir.[36] BAL lenfositozu sarkoidoz için spesifik değildir. Hipersensitivite pnömonisi, nonspesifik interstisyel pnömoni veya organize pnömoni gibi diğer birçok hastalıkta da görülebilir.
BAL sıvısında CD4/CD8 oranı sarkoidozda değişkenlik gösterdiği için tanıdaki önemi tartışmalıdır.[37] CD4/CD8 oranı tanı anında hastaların sadece %55’inde artar. Oran hastaların %15’inde 1.0’ın altındadır. Bir çalışmada lenfosit CD4/CD8 >3.5 olmasının sarkoidoz tanısı için sensitivitesi %53, spesifitesi %94, pozitif prediktif değeri %76 ve negatif prediktif değeri %85 olarak bulunmuştur.[38] CD4/CD8 oranı özellikle Löfgren sendromunda ve akut sarkoidozlu hastalarda yüksektir. İnaktif hastalıkta, oran genellikle normaldir. Klinik/radyolojik görüntüsü tipik sarkoidozla uyumlu olan hastalarda, BAL’da CD4/CD8 oranının artmış olması sarkoidoz tanısını doğrulayabilir ve ek biyopsiye gerek kalmayabilir.
Farklı radyolojik ve klinik durumdaki pulmoner sarkoidozlarda BAL sıvısındaki CD4/CD8 oranının tanısal rolünün araştırıldığı bir çalışmada; (1) BAL sıvısında lenfosit yüzdesinin ve CD4/CD8 oranının arttığı, (2) Sarkoidozlu olguların %7’sinde BAL sıvısı hücre sayımının normal olduğu, (3) CD4/CD8 oranının optimal cutoff noktalarının asemptomatik hastalar için 3.5, semptomatik hastalar için 4.0 olduğu, (4) Semptomatik hastalar ile karşılaştırıldığında optimal cutoff noktasının sensitivitesinin asemptomatik hastalarda daha düşük olduğu, (5) Sarkoidozun evresi arttıkca optimal cutoff noktasının sensitivitesinin azaldığı bulunmuştur.[39] Özdemir ve ark.[40] ise, sarkoidozlu 50 hastada apoptotik molekül olan CD95(Fas)’ın BAL sıvısı konsantrasyonunun, spontan remisyon ile kıyaslandığında, kronik sarkoidozlu hastalarda anlamlı olarak yüksek olduğunu göstermişlerdir.
Biyopsi İşlemleri
Biyopsi yeri hastalığın klinik görünümüne bağlı olarak hastadan hastaya değişir. Genel olarak en kolay ulaşılabilen ve morbiditesi en az olan yer tercih edilmelidir. Örneğin, cilt biyopsisinin komplikasyon riski diğer organ biyopsilerine göre en düşüktür. Bu nedenle şüpheli sarkoidozlu bir hastada dikkatli bir cilt muayenesi yapılmalıdır. Hastaya skarları veya dövmesi olup olmadığı sorulmalıdır. Çünkü bu bölgede gelişen nodüller genellikle granülomatöz reaksiyonlardır. Büyümüş periferik lenf nodları, lakrimal gland ve eğer nodüller görünüyorsa konjunktiva diğer biyopsi yerleridir. Karaciğer ve kemik iliği biyopsisinin kazeifikasyon göstermeyen granülomları nonspesifiktir. Enfeksiyon ilaç reaksiyonu veya malignite gibi aynı görünümü yapan durumlar ekarte edildikten sonra tanıyı destekler.[2,25] Eritema nodosum panniculitis olup granülom içermez. Bu nedenle biyopsi için uygun değildir. Ülkemizde yapılan bir çalışmada dudak biyopsisinin tüberküloz ve sarkoidozu ayırmada yararlı olduğu saptanmıştır. Tüberkülozlu hastalarda dudak biyopsisi negatif çıkarken, sarkoidozlu hastaların yaklaşık yarısında granülom görüldüğü bulunmuştur.[41]
Hastaların %95’inde torakal tutulum olduğu için, tanısal değeri oldukca yüksek olan fiberoptik bronkoskop ile akciğer ve mediastinal lenf bezi biyopsisi yapılır. Transbronşiyal akciğer biyopsisinin (TBAB) tanısal doğruluğu, bronkoskopistin deneyimine de bağlı olarak 4-5 biyopsi örneği elde edildiğinde %40-%90’dan fazladır.[2,7] Transbronşiyal akciğer biyopsisi, radyolojik olarak parankimal lezyonları olanlarda (radyolojik evre II veya III), normal akciğer parankimi olanlardan (radyolojik evre 0 veya I) daha tanısaldır.[42] İlerlemiş fibrokistik sarkoidozda, transbronşiyal akciğer biyopsisinin fibrotik değişikliklerden dolayı, tanısal verimliliği düşüktür. Pnömotoraks veya kanama gibi komplikasyonlar görülebilir. Endobronşiyal nodül veya kaldırım taşı görünümünün olmadığı, bronş mukozasının normal göründüğü durumlarda bile endobronşiyal biyopside histolojik olarak granülom görülebilir. Endobronşiyal biyopsinin sarkoidozda tanısal yararı %40-60’dır.[25] Transbronşiyal akciğer biyopsisi ile birlikte yapıldığında tanısal değeri artar. Konvansiyonel transbronşiyal iğne aspirasyonu (TBİA) ile intratorasik lenf nodlarından örnek elde edilebilir. Evre I veya II sarkoidozda, TBAB ile kombine edildiğinde, TBİA’nın tanısal değeri artar (sensitivitesi %90’dan fazla).
Lineer ekoendoskoplardaki güncel gelişmelerle pulmoner sarkoidozda yeni tanısal yöntemler ortaya çıkmıştır. Ultrason eşliğinde transözofagial ince iğne aspirasyonu (EUS-TÖİA) ve bronkoskopik endobronşiyal ultrason eşliğinde transbronşiyal iğne aspirasyonunun (EBUS-TBİA) her ikisi de güvenli ve minimal invaziv işlemlerdir (Resim 3.5).
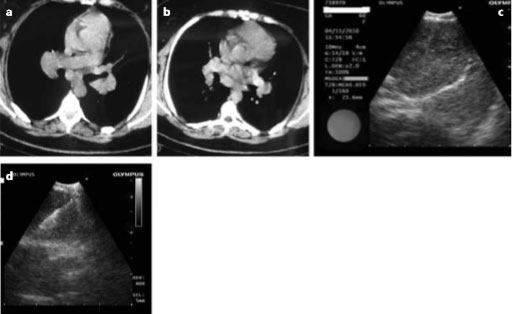
Resim 3.5: 26 yaşında kadın hasta. (a ve b) Toraks bilgisayarlı tomografisinde hiler ve subkarinal büyümüş lenf nodları. (c) Subkarinal lenf nodunun endobronfliyal ultrasonografi (EBUS) görüntüsü, lenf nodunun sınırları düzenli ve hipoekojen olarak izlenmekte. (d) Aynı lenf nodunun Convex-probe EBUS rehberliğinde transbronfliyal iğne aspirasyonu, lenf nodunun içinde iğne izlenmekte (Dr. Aydın Yılmaz ve Dr. Nilgün Demirci’nin arflivi. Değerli izinleri ile kullanılmıştır).
Şüpheli pulmoner sarkoidozlu hastalarda, transözofagial EUS-TÖİA kullanılarak yapılan çalışmalarda tanısal verimlilik %82-86, sensitiviteler %89-100 ve spesifiteler %94-96 bulunmuştur.[6,43] Real-time EBUS-TBİA’nın tanısal verimliliği %83-93 olarak raporlanmıştır; spesifite ise %100’dür.[44,48] Bu çalışmalarda sadece şüpheli sarkoidozu olup bilgisayarlı tomografide büyümüş hiler veya mediastinal lenf nodu olan hastalar alınmış olup komplikasyona rastlanmamıştır. Normal büyüklükte lenf nodu olan hastalarda EBUS-TBİA’nın değeri bilinmemektedir. EBUS-TBİA’nın tanısal verimliliği 5 örnek alınmasında %80’ni aşar; 7 seferden sonra artış yoktur.[46] Tanısal verimlilik en yüksek evre I’de, bunu takiben evre II’de, en düşük ise evre III’dedir. Standart TBİA (26 hasta) ile EBUS-TBİA’nın (24 hasta) karşılaştırıldığı randomize kontrollü bir çalışmada EBUS-TBİA’nın verimliliğinin %29.5 daha fazla olduğu bulundu.[47] Standart TBİA grubunda sensitivite ve spesifite sırasıyla %60.9 ve %100 ve EBUS-TBİA grubunda ise %83.3 ve %100 (sensitivitede artış %22.4) idi.[47] EUS-TÖİA ile EBUS-TBİA arasındaki major fark lenf nodlarına erişme yeteneğidir. EBUS-TBİA ile paratrakeal (2 ve 4. istasyonlar), subkarinal (7. istasyon) ve hiler lenf nodlarını (10 ve 11. istasyonlar) da içeren çok sayıda lenf nodu istasyonuna ulaşım sağlanır. EUS-TÖİA ile sol ve aşağı mediastinal ve paraözofagial istasyonlara (4L, 5, 7, 8, 9) ulaşılır.[49] Sarkoidozda daha sıklıkla tutulan hiler ve trakeanın anterolateralindeki lenf nodlarına ulaşım EUS-TÖİA için genellikle güçtür. Son zamanlarda, 15 merkezin katılımı ile yapılan çok merkezli bir çalışmada, ilk negatif bronkoskopik işlemlerden (endobronşiyal ve transbronşiyal biyopsiler) sonra yapılan endoskopik ultrasonun (EUS veya EBUS) ilave tanısal değeri olduğu gösterilmiştir.[50]
Bronkoskopinin tanısal olmadığı durumlarda, mediastinal lenfadenopatili hastalara, özellikle lenfoma, metastatik hastalık veya enfeksiyonları dışlamak için mediastinoskopi yapılması önerilmektedir. Mediastinoskopi oldukça invaziv, pahalı bir işlemdir. Olguların %2-3’ünde komplikasyonlara neden olmasına karşın morfolojik tanı için halen altın standarttır.[49] Tanı konamayan, pulmoner infiltrasyonları olan hastalara da video eşliğinde torakoskopik akciğer biyopsisi veya açık akciğer biyopsisi yapılması önerilmektedir.
Patoloji
Hemen her vakada sarkoidoz tanısını koymak için granülomlar gerekli olsa da, granülomların nonspesifik enflamatuar reaksiyonlar olduğunu bilmek önemlidir. Granülomlar sarkoidoz veya diğer başka granülomatöz hastalıklar için tanısal değildir. Her biyopsi mikobakteri, mantar, parazitler ve yabancı cisimler (örneğin talk) gibi granülomatöz enflamasyon nedenleri açısından araştırılmalıdır. Sarkoidoz granülomlarının spesifik tanısal özellikleri olmasa da, tanıyı düşündürecek bazı tipik karakteristik bulguları olabilir. Sarkoid granülomu sıklıkla mononükleer fagositlerin (makrofaj veya epiteloid hücreler) sıkı (organize) topluluklarından oluşur (Resim 3.6).
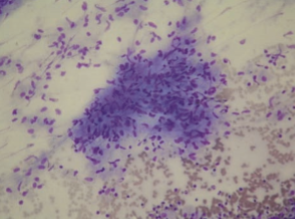
Resim 3.6: Resim 3.5’deki hastanın EBUS eflliğinde yapılan transbronfliyal iğne aspirasyonunun patolojik incelemesinde epiteloid histiositlerden oluflan granülom izlenmekte (Giemsa x400) (Dr. Funda Demirağ’ın arşivi. Değerli izinleri ile kullanılmıştır).
Tipik olarak nekroz yoktur, fakat bazen az miktarda olabilir. Genellikle sarkoid granülomunun içinde dev hücreler, multinükleer dev hücre oluşturmak için birleşir. Bu granülomların çevresinde genellikle periferik lenfositler bulunur. Schaumann cisimcikleri, asteroid cisimcikler, birefrejan kristaller ve Hamazaki-Wesenberg cisimcikleri gibi çeşitli inklüzyonlar olabilir; ancak bu inklüzyonlar nonspesifiktir ve sarkoidoz için tanısal değildir.[51]
Akciğer biyopsilerinde granülom saptandığında tüberküloz, atipik mikobakteriozlar, mantar, pnömosistis karinii, mikoplazma, hipersensitivite pnömonisi, pnömokonyozlar (berilyum, titanyum, alüminyum), ilaç reaksiyonları, yabancı cisim aspirasyonu, Wegener granülomatozisi (sarkoid tipi granülomlar nadirdir), nekrotizan sarkoid granülomatozis; lenf nodunda granülom saptandığında tüberküloz, atipik mikobakterioz, bruselloz, toksoplasmozis, granülomatöz histiositik nekrotizan lenfadenit (Kikuchi hastalığı), kedi tırmığı hastalığı, karsinomanın bölgesel lenf nodlarında sarkoid reaksiyonu, Hodgkin hastalığı, Non-Hodgkin lenfomalar, önemi bilinmeyen granülomatöz lezyon (GLUS sendromu) ekarte edilmelidir.[2]
Histolojik spesmenler enfeksiyon ajanları ve yabancı cisimler yönünden dikkatlice gözden geçirilmelidir. Spesmenler en azından mikobakteri ve tüberküloz açısından boyanmalı ve bu organizmaların kültürleri yapılmalıdır. Mesleki maruziyet (berilyum gibi), çevresel maruziyet (hipersensitivite pnömonisine neden olan organik biyoaerosoller) ve enfeksiyon ajanlarına maruziyet (tüberküloz gibi) öyküsü detaylı olarak alınmalıdır. Eğer tıbbi öykü olası bir alternatif tanıyı düşündürüyorsa berilyum lenfosit proliferasyon testi (kronik berilyum hastalığı için) ve hipersensitivite pnömonisi için antikor testleri yapılmalıdır.
Genetik
Son yıllarda genetik gelişmelerle, Löfgren sendromunda human lökosit antijen (HLA) DRB1 *0301/DQB1*0201 pozitif hastaların yaklaşık %99’unda spontan remisyon olduğunu, buna karşın HLA DRB1*0301/DQB1 *0201 negatif hastaların sadece %55’inde spontan remisyon olduğu gösterilmiştir.[52] Bu alleller Löfgren sendromunda prognozu tahmin etmede önemli bir faktör olarak görünmektedir.
İmmunglobulin gen superailesinin bir üyesi olan butirofillin-benzeri 2 (BTNL2) geni HLA sınıf II ve sınıf III bölgelerinin kesiminde lokalizedir ve T-hücre aktivitesini down regüle ettiği görülür. BTNL2 polimorfizminin sarkoidoz için bağımsız bir risk faktörü olduğu gösterilmiştir.[4,53]
Kaynaklar
- Hunninghake GW, Costabel U, Ando M, et al. ATS/ERS/WASOG statement on sarcoidosis. American Thoracic Society/European Respiratory Society/World Association of Sarcoidosis and other Granulomatous Disorders. Sarcoidosis Vasc Diffuse Lung Dis 1999;16:149-73.
- Judson MA. The diagnosis of sarcoidosis. Clin Chest Med 2008;29:415-27.
- Baughman RP, Culver DA, Judson MA. A concise review of pulmonary sarcoidosis. Am J Respir Crit Care Med 2011;183:573-81.
- Costabel U, Ohshimo S, Guzman J. Diagnosis of sarcoidosis. Curr Opin Pulm Med 2008;14:455-61.
- Judson MA. Sarcoidosis: clinical presentation, diagnosis, and approach to treatment. Am J Med Sci 2008;335:26-33.
- Costabel U, Bonella F, Ohshimo S, Guzman J. Diagnostic modalities in sarcoidosis: BAL, EBUS, and PET. Semin Respir Crit Care Med 2010;31:404-8.
- Parrish S, Turner JF. Diagnosis of sarcoidosis. Dis Mon 2009;55:693-703.
- Baughman RP, Teirstein AS, Judson MA, et al.; ACCESS Research Group. Clinical characteristics of patients in a case control study of sarcoidosis. Am J Respir Crit Care Med 2001;164:1885-9.
- Judson MA, Thompson BW, Rabin DL. The diagnostic pathway to sarcoidosis. Chest 2003;123:406-12.
- Rybicki BA, Iannuzzi MC, Frederick MM, et al.; ACCESS Research Group. Familial aggregation of sarcoidosis. A case-control etiologic study of sarcoidosis (ACCESS). Am J Respir Crit Care Med 2001;164:2085-91.
- Judson MA, Baughman RP, Teirstein AS, Terrin ML, Yeager H Jr. ACCESS Research group. Defining organ involvement in sarcoidosis: the ACCESS proposed instrument. Sarcoidosis Vasc Diffuse Lung Dis 1999;16:75-86.
- Judson MA, Baughman RP, Thompson BW, et al.; ACCESS Research Group. Two year prognosis of sarcoidosis: the ACCESS experience. Sarcoidosis Vasc Diffuse Lung Dis 2003;20:204-11.
- Winterbauer RH, Hutchinson JF. Use of pulmonary function tests in the management of sarcoidosis. Chest 1980;78:640-7.
- Baughman RP, Sparkman BK, Lower EE. Six-minute walk test and health status assessment in sarcoidosis. Chest 2007;132:207-13.
- De Prost N, Kerrou K, Sibony M, Talbot JN, Wislez M, Cadrenel J. Fluorine-18 fluorodeoxyglucose with positron emission tomography revealed bone marrow involvement in sarcoidosis patients with anaemia. Respiration 2010;79:25-31.
- Sharma OP. Vitamin D, calcium, and sarcoidosis. Chest 1996;109:535-9.
- Iannuzzi MC, Rybicki BA, Teirstein AS. Sarcoidosis. N Engl J Med 2007;357:2153-65.
- Studdy PR, Bird R. Serum angiotensin converting enzyme in sarcoidosis – its value in present clinical practice. Ann Clin Biochem 1989;26 (Pt 1):13-8.
- Studdy PR, James DG. The specificity and sensitivity of serum angiotensin-converting enzyme in sarcoidosis and other diseases. In: Chretien J, Marsac J, Saltiel JS, editors. Sarcoidosis. Paris: Pergamon Press; 1983. p. 332-44.
- Rigat B, Hubert C, Alhenc-Gelas F, Cambien F, Corvol P, Soubrier F, et al. An insertion/deletion polymorphism in the angiotensin I-converting enzyme gene accounting for half the variance of serum enzyme levels. J Clin Invest 1990;86:1343-6.
- Biller H, Zissel G, Ruprech B, Nauck M, Busse Grawtz A, Müller-Quernheim J. Genotype-corrected reference values for serum angiotensin-converting enzyme. Eur Respir J 2006;28:1085-90.
- Pietinalho A, Ohmichi M, Lofroos AB, Hiraga Y, Selroos O. The prognosis of sarcoidosis in Finland and Hokkaido, Japan. A comparative five year study of biopsy-proven cases. Sarcoidosis Vasc Diffuse Lung Dis 2000;17:158-66.
- Costabel U, Teschler H. Biochemical changes in sarcoidosis. Clin Chest Med 1997;18:827-42.
- Kieszko R, Krawczyk P, Chocholska S, et al. Tumor necrosis factor receptors (TNFRs) on T lymphocytes and soluble TNFRs in different clinical courses of sarcoidosis. Respir Med 2007;101:645-54.
- Moller DR. Systemic sarcoidosis. Fishman AP, Elias JA, Fishman JA, Grippi MA, Jenior RM, Pack AI, editors. Fishman’s Pulmonary Diseases and Disorders. 4th ed. Vol. 1. London: McGraw-Hill; 2008. p. 1125-42.
- Costabel U, Hunninghake GW. ATS/ERS/WASOG statement on sarcoidosis. Sarcoidosis Statement Committee. American Thoracic Society. European Respiratory Society. World Association for Sarcoidosis and Other Granulomatous Disorders. Eur Respir J 1999;14: 735-7.
- Reich JM, Brouns MC, O’Connor EA, Edwards MJ. Mediastinoscopy in patients with presumptive stage I sarcoidosis: a risk/benefit, cost/benefit analysis. Chest 1998;113:147-53.
- Webb WR, Müller NL, Naidich DP. High Resolution CT of the Lung. 3rd ed. Philadelphia: Lippincott. Williams & Wilkins; 2001. p. 286-303.
- Nishiyama Y, Yamamoto Y, Fukunage K, et al. Comparative evaluation of 18F-FDG PET and 67 Ga scintigraphy in patients with sarcoidosis. J Nucl Med 2006;47:1571-6.
- Teirstein AS, Machac J, Almeida O, Lu P, Padilla ML, Iannuzzi MC. Results of 188 whole-body fluorodeoxyglucose positron emission tomography scans in 137 patients with sarcoidosis. Chest 2007;132:1949-53.
- Kaira K, Oriuchi N, Otani Y, et al. Diagnostic usefulness of fluorine-18-alpha-methyltyrosine positron emission tomography in combination with 18 F-fluorodeoxyglucose in sarcoidosis patients. Chest 2007;131:1019-27.
- Keijsers RGM, Verzijlbergen JF, van Diepen DM, van den Bosch JM, Grutters JC. 18F-FDG PET in sarcoidosis: an observational study in 12 patients treated with infliximab. Sarcoidosis Vasc Diffuse Lung Dis 2008;25:143-9.
- Tadamura E, Yamamuro M, Kubo S, et al. Effectiveness of delayed enhanced MRI for identification of cardiac sarcoidosis: comparison with radionuclide imaging. AJR Am J Roentgenol 2005;185:110-5.
- Ohira H, Tsujino I, Ishumaru S, et al. Myocardial imaging with (18) F-Fluoro-2-deoxyglucose positron emission tomography and magnetic resonance imaging in sarcoidosis. Eur J Nucl Med Mol Imaging 2008;35:933-41.
- Drent M, Mansour K, Linssen C. Bronchoalveolar lavage in sarcoidosis. Semin Respir Crit Care Med 2007;28:486-95.
- Ziegenhagen MW, Rothe ME, Schlaak M, Müller-Quernheim J. Bronchoalveolar and serological parameters reflecting the severity of sarcoidosis. Eur Respir J 2003;21:407-13.
- Kantrow SP, Meyer KC, Kidd P, Raghu G. The CD4/CD8 ratio in BAL fluid is highly variable in sarcoidosis. Eur Respir J 1997;10:2716-21.
- Nagai S, Izumi T. Bronchoalveolar lavage. Still useful in diagnosing sarcoidosis? Clin Chest Med 1997:18:787-97.
- Danila E, Norkuniene J, Jurgauskiene L, Malickaite R. Diagnostic role of BAL fluid CD4/CD8 ratio in different radiographic and clinical forms of pulmonary sarcoidosis. Clin Respir J 2009;3:214-21.
- Özdemir ÖK, Çelik G, Dalva K, Ülger F, Elhan A, Beksaç M. High CD95 expression of BAL lymphocytes predicts chronic course in patients with sarcoidosis. Respirology 2007;12:869-73.
- Tabak L, Ağırbaş E, Yılmazbayhan D, Tanyeri H, Güç U. The value of labial biopsi in the differentiation of tuberculosis from sarcoidosis. Sarcoidosis Vasc Diffuse Lung Dis 2001;18:191-5.
- Gilman MJ, Wang KP. Transbronchial lung biopsy in sarcoidosis. An approach to determine the optimal number of biopsies. Am Rev Respir Dis 1980;122:721-4.
- Wildi SM, Judson MA, Fraig M, et al. Is endosonography guided fine needle aspiration (EUS-FNA) for sarcoidosis as good as we think? Thorax 2004;59:794-9.
- Wong M, Yasufuku K, Nakajima T, et al. Endobronchial ultrasound: new insight for the diagnosis of sarcoidosis. Eur Respir J 2007;29:1182-6.
- Oki M, Saka H, Kitagawa C, et al. Real-time endobronchial ultrasound-guided transbronchial needle aspiration is useful for diagnosing sarcoidosis. Respirology 2007;12:863-8.
- Garwood S, Judson MA, Silvestri G, Hoda R, Fraig M, Doelken P. Endobronchial ultrasound for the diagnosis of pulmonary sarcoidosis. Chest 2007;132:1298-304.
- Tremblay A, Stather DR, MacEachern P, Khalil M, Field SK. A randomized controlled trial of standard vs endobronchial ultrasonography- guided transbronchial needle aspiration in patients with suspected sarcoidosis. Chest 2009;136:340-6.
- Nakajima T, Yasufuku K, Kurosu K, et al. The role of EBUS-TBNA for the diagnosis of sarcoidosis –comparisons with other bronchoscopic diagnostic modalities. Respir Med 2009;103:1796-1800.
- Miliauskas S, Zemaitis M, Sakalauskas R. Sarcoidosis – moving to the new standard of diagnosis? Medicina (Kaunas) 2010;46:443-6.
- Tournoy KG, Bolly A, Aerts JG, et al. The value of endoscopic ultrasound after bronchoscopy to diagnose thoracic sarcoidosis. Eur Respir J 2010;35:1329-35.
- Rosen Y. Pathology of sarcoidosis. Semin Respir Crit Care Med 2007;28:36-52.
- Grunewald J, Eklund A. Sex- specific manifestations of Lofgren’s syndrome. Am J Respir Crit Care Med 2007;175:40-4.
- Iannuzzi MC. Advances in the genetics of sarcoidosis. Proc Am Thorac Soc 2007;4:457-60.
