Histopatoloji
Sarkoidozis, uyarılmış CD4+Th1 hücrelerinin bilinmeyen bir ajana organize immün cevap sonucu granülom formasyonunun ortaya çıkması ile karakterizedir.[5]
Granüloma terimi, 1976 yılında Adams[6] tarafından matür mononükleer fagositlerin (makrofaj ve/veya epiteloid hücreler) organize olarak bir araya gelmesi olarak tanımlanmıştır. Beraberinde lökositlerin infiltrasyonu veya nekroz eşlik edebilir diye açıklanmıştır. O zamandan beri bilgilerimiz artmakta, enflamatuar ve immünokomponent hücreler arasında ilişkiler ağının granülom formasyonunu oluşturduğu bilinmekle beraber, Adams’ın tanımı hala güncelliğini korumaktadır.
Granülomlar, patolojik olarak makrofajlardan oluşan epiteloid hücreler ve dev hücrelerin varlığında, gecikmiş immün yanıt hücrelerinin organizasyonu ile oluşur. Farklı etiyolojilere sahip hastalıklarda görülen granülomlardaki yapısal benzerlikten dolayı, granülomatöz enflamasyonu genel fizyopatolojik sinyallerin düzenlediği ileri sürülmektedir.
Fizyolojik bakış açısı ile granülom; Mycobacterium tuberculosis, Schistosoma ve fungal organizmalar gibi kronik enflamasyon oluşturan kronik patojenlere karşı koruyucu bir cevaptır. Bununla beraber granülomlar, Listeria[7] veya Salmonella gibi akut enfeksiyonlarda da görülebilmektedir. Enfeksiyon süresince granülomanın fonksiyonu, organizmanın yayılımını önlemek için patolojik ajanın tutulması ve enflamatuar reaksiyon ile sınırlamaktır. Ne var ki, granülomatöz enflamasyon, enfektif mikroorganizmanın olmadığı Crohn hastalığı,[8] Wegener granülomatozu,[9] lenfoma ile meme ve akciğerin epiteloid tümörlerinde de[10-13] görülür. Granülom yapısı, etiyolojisi bilinmeyen granüloma annularede,[14] sarkoidozda[15] olduğu gibi hastalığın belirteci olarak karşımıza çıkabilir.
Histolojik özellikler
Klasik olarak tutulan tüm dokularda non-kazeifiye (kazeifikasyon nekrozu göstermeyen) granülomlar görülür.[16] Granülomlar kompakt ve çevre parankimden farklı yapılardır. Granülomlar baskın olarak epiteloid histiositlerden, periferde ise lenfositler ile Langhans veya yabancı cisim tipi multinükleer dev hücrelerden oluşur (Resim 2.1).
Granülomların yaklaşık olarak %60’ında dev hücrelerde sıklıkla laminer dizilim gösteren kalsiyum ve proteinlerden oluşan Schaumann cisimleri, yıldız görünümünde asteroid cisimleri, ışığı çift kıran kalsiyum oksalat kristalleri ve Hamazaki-Wesenberg cisimleri gibi diğer granülomatöz hastalıklarda da görülebilen inklüzyon cisimleri bulundururlar. Fakat bu inklüzyonlar, sarkoidoz tanısı için spesifik ve tanısal değildir[17] (Resim 2.2).
Granülomlarda santral nekroz odakları nadirdir, genellikle ufak ve apoptotik cisimler ile beraberdir. Gomori metenamin silver (GMS) ve Ehrlich-Ziehl-Neelsen boyaları, bütün olgularda fungal ve mikobakteriyel enfeksiyonları dışlamak için yapılmalıdır. Geç dönem sarkoidozda, granülomlar kısmen veya tamamen ortadan kalkarak, zamanla fibroz bantlarla çevrili lezyonlara veya hyalin fibröz skarlara dönerler.
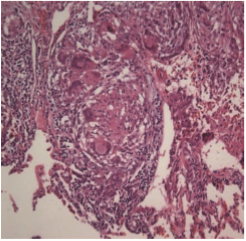
Resim 2.1: Baskın olarak epiteloid histiositlerden, periferde ise lenfositler, Langhans veya yabanc› cisim tipi multinükleer dev hücrelerden oluflan granülomlar (HE x200).
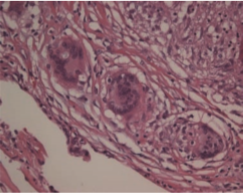
Resim 2.2: Dev hücrede görülen, kalsiyum ve proteinlerden oluflan Schaumann inklüzyon cismi (HE x400)
Akciğerler
En yaygın olarak tutulum gösteren organdır.[18] Makroskopik olarak bazen granülomların bir araya gelmesi ile palpe edilebilen ve görülebilen 1-2 cm çapında kazeifikasyon ve kavitasyon göstermeyen solid kitleler oluştururlar. Histolojik olarak sarkoidozun erken safhalarında granülom yapılarının izlenmediği interstisyel ve alveoler lenfositik infiltrasyon görülebilir. Akciğerde granülomlar, klasik olarak subplevral ve bronkovasküler dallanmalar boyunca perilenfatik yerleşim gösterirler (Resim 2.3).
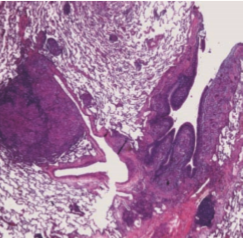
Resim 2.3: Peribronfliyal alanda perilenfatik yerleflim gösteren granülom yap›lar› (HE x20).
Plevral yüzeyler bazen tutulum gösterirler. Bronkoskopi yoluyla alınan biyopsilerde, bronş submukozasına yerleşimli granülomların tanısı, diğer yerleşim alanlarına göre daha yüksek oranda konur. Bronşiyoloalveolar lavajda, lenfositler baskın olup, CD4/CD8 oranı >2.5 ve CD3/CD4 oranı <0.31’dir. Akciğerlerdeki lezyonlar hızla iyileşme eğilimindedir. Bu yüzden çeşitli evrelerde fibrozis ve hyalinizasyona rastlanır.
Lenf Nodları
Hemen tüm olgularda, herhangi bir lenf nodu olabildiği gibi özellikle hiler ve mediastinal lenf nodları tutulum gösterirler. Klasik olarak büyümüş, bazen kalsifiye yapıdadırlar. Tonsiller olguların 1/3 ila 1/4’ünde tutulum gösterirler.
Dalak
Mikroskopik olarak olguların 3/4’ünde tutulum gösterirler. Ancak sadece 1/5’inde büyüme görülür. Nadiren granülomlar küçük nodüller yapacak şekilde bir araya gelerek, makroskopik olarak görülebilecek hale gelirler. Kapsülde tutulum görülmez.
Karaciğer
Dalağa oranla daha az sıklıkta tutulur. Hafif olarak büyüme gösterir, az sayıda granülom yapıları izlenir. Granülomlar parankimden ziyade portal alanlarda görülür. Bu fokal lezyonların tanısında iğne biyopsisi faydalı olabilir.
Kemik İliği
Sistemik tutulumlarda olguların 1/5’inde kemiklerde radyolojik olarak değişiklikler tespit edilebilir. Radyolojik olarak, el ve ayaklarda falangial kemiklerde, kemik yıkımına bağlı küçük iyi sınırlı litik lezyonlar olarak görülür. Kemik şarftını genişleten veya dış yüzeyinde yeni kemik yapımına neden olan diffüz retiküler tutulum izlenir.
Deri Lezyonları
Olguların 1/2 ile 1/3’ünde görülürler. Deri lezyonları; birbirinden ayrı subkutanöz nodüller, fokal hafifçe yükselmiş eritematöz plaklar veya hafifçe kızarıklık ve kabuklanma gösteren lupus eritematozusa benzer farklı makroskopik görünümlerde karşımıza çıkabilir. Lezyonlar oral kavitede, larinkste ve üst solunum yolu muköz membranlarında görülebilir.
Göz
Glandlar ve tükürük bezi ile bağlantılı olarak olguların 1/5 ile 1/2’sinde tutulum gösterirler. Oküler lezyonlar tek veya çift taraflı olarak iritis veya iridosiklitis şeklinde karşımıza çıkabilir. Sonuç olarak korneal opasiteler, glokom, total görme kaybı olabilir. Gözdeki bu lezyonlar, genellikle tükürük salınımını durduran lakrimal tükürük bezlerindeki enflamasyonla birliktelik gösterir. Parotis, submaksiller ve sublingual tükürük bezlerinin sarkoidozla beraber tutulması sonucu ortaya çıkan üveoparotid, Mikulicz sendromu olarak bilinir.
Kaslar
Asemptomatik oldukları için normalden daha az tanı alırlar. Kaslarda zayıflama, ağrı, hassaslık ve yorgunluk, sinsi giden sarkoid myozitis ihtimalini aklımıza getirmelidir. Bilateral hiler lenfadenopatisi olan, asemptomatik giden 22 hastanın, gastrokinemius kasından alınan biyopsilerin hepsinde kazeifikasyon göstermeyen granülom yapıları tespit edilmiştir.[19] Sarkoid granülomlar diğer organlarda olduğu gibi kalp kası, böbrekler, santral sinir sistemi ve endokrin glandlarda özellikle pitüiter bezde nadiren görülür.
Farklı Organ Tutulumları
Tek bir organda nonkazeifiye granülomların olması, sarkoidoz tanısı koydurtmaz. Çünkü sarkoidoz tanım gereği, çok sayıda organı tutması gerekir. Tek organda görülen idiopatik granülomatöz hastalığın, sarkoidozdan ayrımı yapılmalıdır. Örneğin karaciğerde nedeni bilinmeyen kazeifikasyon göstermeyen granülomların bulunduğu idiopatik granülomatöz hepatitis olguları nadiren sarkoidozda izlenir.[20] İdiopatik panüveitis, başka organ tutulumu göstermeyen granülomatöz üveit olup, ABD’nin güneydoğusunda yaygın olarak görülür.[21]
Biyopsi Yerinin Seçimi
Klinik bulgular genellikle sarkoidoz tanısını için spesifik değildir. Bundan dolayı, tanı için doku biyopsisi alınmasına ihtiyaç duyulur. Pulmoner veya diğer organlarda sarkoidoz tutulumu olduğunda, biyopsi yeri için morbitide açısından en az riskli bölge seçilmeye çalışılır. Örneğin, deri biyopsisi diğer organlara göre daha az komplikasyon riski taşır. Bu yüzden sarkoidoz kuşkusu olan hastalarda dikkatli deri incelenmesi yapılmalıdır. Hastaların granülomatöz lezyonların daha fazla geliştiği özellikle skar ve dövme bölgeleri değerlendirilmelidir. Diğer biyopsi bölgeleri olarak, büyümüş periferik lenf nodları veya nodül bulunduran konjuktiva seçilmelidir.[22]
Transbronşiyal akciğer biyopsileri (TBB) ile akciğer sarkoidozunun tanı diğeri %40-%90 arasındadır. Tanı değerini arttırmak için her seferinde dört-beş adet biyopsi örneğinin alınması önerilmektedir. TBB nin tanı değeri, radyolojik olarak parankimal tutulum gösteren (radyolojik evre II-III) hastalarda tutulum göstermeyen (radyolojik evre 0-I) hastalara kıyasla daha yüksektir.[23]
Bilateral hilar lenf adenopatisi olan hastalarda TBB nin tek başına tanı değeri yaklaşık %50’dir.[24,25] Geçmişte kullanıllan mediastinaskopi ile yapılan tanısal girişimler, pahalı ve morbitite riski yüksek girişimlerdi.[26] Son zamanlarda ultrason yardımı ile yapılan endobronşiyal iğne aspirasyonlarında (EBUS) tanı değeri %90’a yükselmiştir.[27,28] Ayrıca ucuz ve morbidite oranının düşük olması nedeni ile EBUS, bilateral hilar lenf adenopatisi olan ve sarkoidoz düşünülen hastalarda tercih edilmektedir.
Bronşiyoloalveolar lavaj (BAL) ile lenfosit popülasyonunun CD4/CD8 oranının araştırılması, bazen tanıyı destekleyici bir işlem olarak yapılmaktadır. BAL incelemesinde, lenfosit oranının %15’in üzerinde olmasının, sarkoidoz tanısındaki sensivitesi %90 dolayında olmakla beraber spesifitesi düşüktür.[29] CD4/CD8 oranı 3.5’ten büyük ise, sensivitesi %53, spesifitesi %94, pozitif prediktif değeri %76 negatif prediktif değeri %85’dir.[29]
Granülomatöz Enflamasyonda Diğer Nedenlerin Ortadan Kaldırılması
Tablo 2.1’de sarkoidoz tanısı konulmadan önce dışlanması gereken diğer granülomatöz enflamasyon yapan nedenler sıralanmıştır. Bunun için sistemik bir yaklaşım kullanılmalıdır. Granülomlarda olabilecek enfeksiyöz ajanlar ve yabancı cisimler araştırılmalıdır. Mikobakteriozis ve fungal organizmalar için gerekli boyamalar yapılmalıdır. Bu organizmalar için gerekli olan kültürler alınmalıdır. Berilyum gibi işe bağlı hastalıklar, organik biyoaerosol etkileşimleri sonucu oluşan çevresel etkene bağlı hastalıklar ve tüberküloz gibi potansiyel ajana bağlı etkileşimler detaylı anamnez alınarak saptanabilir. Berilyuma bağlı hipersensitivite, sarkoidozlu hastaların %40’ında saptanmıştır.[31]
Eğer anamnez farklı bir tanıyı desteklerse, ek bazı testler yapmak gerekir. Kronik berilium hastalığı için, berilyum lenfosit proliferasyon testi veya hipersensitivite pnömonisi için antikor testi yapılabilir.[32]
Sarkoidoz tanısı koymak için iki farklı organ tutulumunun gösterilmesi gerekse de, ikinci organ için histolojik olarak doğrulamaya gerek yoktur. Örneğin deride kazeifikasyon göstermeyen granüloma tanısının konulması tek başına sarkoidoz tanısı almasına yetmez. Ancak beraberinde akciğer grafisinde bilateral hiler lenfadenopati varsa ikinci organ tutulumu yeterli sayılır.
Biyopsi yapılmadan hangi durumlarda ikinci organ tutulumunun kabul edilebileceği Tablo 2.2’de gösterilmektedir.[33]
| Tablo 2.1: Biyopsi bölgesine göre sarkoidoz ile ayırıcı tanısı yapılacak diğer ana nedenler.[30] |
|---|
Akciğer
|
Lenf nodu
|
Deri
|
Karaciğer
|
Kemik iliği
|
Diğer biyopsi bölgeleri
|
| Tablo 2.2: Bir organda biyopsi ile kazeifiye olmayan granülom tanısı konulmuş, diğer organlarda ekstrapulmoner sarkoidoz tanısı için gerekli klinik kriterler. | |||
|---|---|---|---|
| Organ | Kesin | Muhtemel | Olası |
| Akciğer | Göğüs röntgeninde aflaşağıdakilerden bir ya da fazlası; Bilateral hiler adenopati Diffüz pulmoner infiltrasyon Üst lob fibrozisi Akciğer fonksiyon testlerinde restriksiyon |
BAL’da lenfositik alveolitis Pulmoner infiltrasyon izole karbon monoksit Difüzyon kapasitesinde düflme | Herhangi başka bir adenopati Obstrüktif pulmoner fonksiyon test |
| Deri | Lupus pernio Annüler lezyon Eritema nodosum |
Makülopapüler döküntü Yeni nodüller | Keloidler Hipopigmentasyon |
| Göz | Lakrimal glandlarda fliflme Üveit | Görme kaybı İn vivo konfokal mikroskopi (+) |
Glokom Katarakt |
| Karaciğer | Karaciğer fonksiyon testlerinde üç katından fazla artış | BT’de uyumlu görünüm Artmış alkalen fosfataz | |
| Hiperkalsemi/ Hiperkalsiüri/ Nefrolityazis |
Bir nedeni olmadan serum kalsiyum seviyesinde artış | İdrar kalsiyum seviyesinde artış Nefrolityazis analizinde kalsiyum | Nefrolityazis – tafl analizi yapılmamış Nefrolityazis – ailede tafl hikayesi olmaması |
| Nörolojik | MR’da MSS ve meninkste (+) tutulum BOS sıvısında lenfosit veya protein artış Diabetes insipitus Bell paralizisi Kranial sinir disfonksiyonu Periferik sinir biyopsisi PET ile merkezi sinir sistemi ve spinal kord da tutulum |
MR’da diğer anormallikler Açıklanamayan nöropati EMG (+) | Açıklanamayan bafl ağrıları Periferik sinir radikulopatisi |
| Renal | Tedaviye cevap veren renal yetmezlik | Diyabet veya hipertansiyonlu hastada steroid tedavisine cevap veren renal yetmezlik | Diğer bir hastalık olmadan görülen renal yetmezlik |
| Kardiyak | Tedaviye cevap veren kardiyomiyopati EKG’de nodal blok veya intraventriküler ileti defekti PET (+) Galyum sintigrafisi (+) | Ventriküler aritmi ve kardiyomiyopati dışında kardiyak problemin olmamas› Talyum sintigrafisi (+) | Diyabetli ve hipertansiyonlu hastada; ventriküler aritmi ve kardiyomiyopati olması |
| Toraks dışı lenf nodu | Belin üst kısmındada palpe edilen yeni lenf nodu BT’de 2 cm’den büyük lenf nodu | Yeni palpe edilen femoral lenf nodu | |
| Kemik iliği | Açıklanamayan anemi Lökopeni Trombositopeni |
Düşük MVC değeri olan anemi | |
| Dalak | Fizik muayene, BT veya sintigrafide büyüme | ||
| Kemik/ Eklemler | Radyolojik el ve ayaklarda kistik değişiklikler | Asimetrik ağrılı ‘clubbing’ | Nedeni bilinmeyen artirit |
| Kulak/ Burun/ Boğaz | Muayenede granülomatöz tutulumla uyumlu nedeni bilinmeyen horlama | Yeni başlayan sinüzit Yeni bafllayan başdönmesi |
|
| Parotis/ Tükrük bezleri | Simetrik parotit Galyum sintigrafisi (+) | Kuru ağız | |
| Kaslar | Tedavi ile artmış CK/aldolaz oran›nda azalma | CK/aldolaz oranında artma | Tedaviye cevap veren miyalji |
Diğer organ tutulumlarını araştırrmak için kullanılacak yöntemler
|
|||
Kveim-Stilzbach Testi
Sarkoidozun enfeksiyöz bir ajana bağlı olarak geliştiği düşüncesi ile uygulanan eski bir tanı testidir. Sarkoidozlu dalaktan elde edilen substratın intradermal olarak enjekte edilmesi ile yapılır.[34] Eğer 4 ile 6 hafta içinde deride enjeksiyon alanında sert bir nodüler oluşum görülür, biyopsi sonucu sarkoid benzeri granülom yapıları ortaya çıkarsa sarkoidoz tanısı için oldukça spesifiktir. Ne yazık ki, bu testin sensitivitesi ve spesifitesi kullanılan dalağa ve substrata göre değiştiği için, FDA tarafından onaylanmamıştır. Bu yüzden Kveim testi standart bir diagnostik test değildir.
Diğer İdiopatik Sistemik Granülomatöz Hastalıklar
Birçok organı tutan idiopatik granülomatöz sendromların sarkoidozdan ayırt edilmesi gerekmektedir.
Blau sendromu
Granülomatöz artritis, iritis, deri döküntüleri ile beraber ortaya çıkar. Otozomal dominant bir sendrom olup 12 yaş öncesinde görülür. Lezyonların akciğerde görülmemesi ve kalıtsal özellikleri nedeni ile çocukluk çağında görülen sarkoidozdan ayrı bir antite olarak değerlendirilmektedir.[35] Blau sendromu, NOD2/CARD15 genindeki mutasyonlar sonucu oluşur.[36]
GLUS sendromu
1989’da Brincker tarafından tanımlanan GLUS (granulomatous lesions of unknown significance) sendromunda, uzun süreli ateş, karaciğer, kemik iliği, dalak ve lenf nodlarında epiteloid granülomlar görülür. İyi gidişli ve rekürens yapmaya eğilimlidir.
- GLUS’un; Serum angiotensin konverting enzim seviyesinin artmaması,
- Hiperkalsemi görülmemesi,
- Kveim testinin her zaman negatif olması,
- Granülomalardaki T lenfositlerin immün fenotipinin, sarkoidozdaki T lenfositlerden farklı olması nedeni ile sarkoidozun akciğer dışı tutulumunun bir formu olduğu düşünülmektedir.[37]
Nekrotizan sarkoid
granülomatozis (NSG)
Wegener granülomatozunun bir varyantı olarak karşımıza çıkan, az rastlanan bir pulmoner lezyondur.[38] 50’li yaşlarda ortaya çıkar. Erkek-kadın oranı, 2/1 baskınlığındadır. NSG, Wegener’den daha iyi prognoza sahiptir. Granülomatöz anjiitis veya lenfoplasmasitik anjitis tarzında vasküler tutulum gösterebilir. Sistemik bir hastalık olup, akciğer dışı organlarda da görülebilir.[39] Bu hastalığın farklı bir hastalık olduğu veya sarkoidozun bir formu olduğu konusu tartışmalıdır.[40] Birçok rapor; NSG’i, nodüler sarkoidozun bir varyantı olarak görmektedir. NSG’de, iyi yapılı granülom yapılarının lenfatik dağılım göstermesi, sarkoidozla ilişkisini desteklemektedir. Sarkoidozdan farklı olarak damarlarda yaygın nekroz izlenir.[41] Makroskopik olarak gri beyaz renkte, santral nekroz izlenen iyi sınırlı kitleler olarak karşımıza çıkar. Palisat tarzı dağılım gösteren histiositlerin çevrelediği nekroz; süpüratif, kazeöz, enfektif veya fibrinoid karakterde olabilir.
Sarkoid benzeri reaksiyon
Sarkoid benzeri epiteloid granülomalar, karsinom bulunan akciğer loblarının drene olduğu torasik lenf nodlarında görülür. Tanıda klinik hikaye esastır.[42]
Kaynaklar
- Statement on sarcoidosis. Joint Statement of the American Thoracic Society (ATS), the European Respiratory Society (ERS) and the World Association of Sarcoidosis and Other Granulomatous Disorders (WASOG) adopted by the ATS Board of Directors and by the ERS Executive Committee, February 1999. Am J Respir Crit Care Med 1999;160:736-55.
- Hunninghake GW, Costabel, U, Ando M, et al. ATS/ERS/WASOG statement on sarcoidosis. American Thoracic Society/European Respiratory Society/World Association of Sarcoidosis and other Granulomatous Disorders. Sarcoidosis Vasc Diffuse Lung Dis 1999;16:149-73.
- Müller-Quernheim J. Sarcoidosis: immunopathogenetic concepts and their clinical application. Eur Respir J 1998;12:716-38.
- Bons JA, Drent M, Bouwman FG, Mariman EC, van Dieijen-Visser MP, Wodzig WK. Potential biomarkers for diagnosis of sarcoidosis using proteomics in serum. Respir Med 2007;101:1687-95.
- Judson MA, Baughman RP, Thompson BW, et al.; ACCESS Research Group. Two year prognosis of sarcoidosis: the ACCESS experience. Sarcoidosis Vasc Diffuse Lung Dis 2003;20:204-11.
- Rybicki BA, Maliarik MJ, Major M, Popovich J Jr, Iannuzzi MC. Epidemiology, demographics, and genetics of sarcoidosis. Semin Respir Infect 1998;13:166-73.
- Baughman RP, Winget DB, Bowen EH, Lower EE. Predicting respiratory failure in sarcoidosis patients. Sarcoidosis Vasc Diffuse Lung Dis 1997;14:154-8.
- Arcasoy SM, Christie JD, Pochettino A, et al. Characteristics and outcomes of patients with sarcoidosis listed for lung transplantation. Chest 2001;120:873-80.
- Janssen R, Sato H, Grutters JC, et al. Study of clara cell 16, KL-6, and surfactant protein-D in serum as disease markers in pulmonary sarcoidosis. Chest 2003;124:2119-25.
- Miyoshi S, Hamada H, Kadowaki T, et al. Comparative evaluation of serum markers in pulmonary sarcoidosis. Chest 2010;137:1391-7.
- Costabel U. Sarcoidosis: clinical update. Eur Respir J Suppl 2001;32:56s-68s.
- Beirne P, Pantelidis P, Charles P, et al. Multiplex immune serum biomarker profiling in sarcoidosis and systemic sclerosis. Eur Respir J 2009;34: 1376-82.
- Minshall EM, Tsicopoulos A, Yasruel Z, et al. Cytokine mRNA gene expression in active and nonactive pulmonary sarcoidosis. Eur Respir J 1997;10:2034-9.
- Suga M, Iyonaga K, Ichiyasu H, Saita N, Yamasaki H, Ando M. Clinical significance of MCP-1 levels in BALF and serum in patients with interstitial lung diseases. Eur Respir J 1999;14:376-82.
- Antonelli A, Ferri C, Fallahi P, et al. CXCL10 (alpha) and CCL2 (beta) chemokines in systemic sclerosis — a longitudinal study. Rheumatology (Oxford) 2008;47:45-49.
- Srinivas PR, Verma M, Zhao Y, Srivastava S. Proteomics for cancer biomarker discovery. Clin Chem 2002;48:1160-9.
- Hutchens TW, Yip T. New Desorption strategies for the mass spectrometric analysis of macromolecules. Rapid Commun Mass Spectrom 1993;7:576-80.
- Kobayashi J, Kitamura S. Serum KL-6 for the evaluation of active pneumonitis in pulmonary sarcoidosis. Chest 1996;109:1276-82.
- Grutters JC, Fellrath JM, Mulder L, Janssen R, van den Bosch JM, van Velzen-Blad H. Serum soluble interleukin-2 receptor measurement in patients with sarcoidosis: a clinical evaluation. Chest 2003;124:186-5.
- Selroos OBN. Biochemical markers in sarcoidosis. Crit Rev Clin Lab Sci 1986;24:185-216.
- Rothkrantz-Kos S, van Dieijen-Visser MP, Mulder PGH, Drent M. Potential usefulness of inflammatory markers to monitor respiratory functional impairment in sarcoidosis. Clin Chem 2003;49:1510-7.
- Salazar A, Maña J, Fiol C, et al. Influence of serum amyloid A on the decrease of high density lipoprotein-cholesterol in active sarcoidosis. Atherosclerosis 2000;152:497-502.
- Tomita H, Sato S, Matsuda R, et al. Serum lysozyme levels and clinical features of sarcoidosis. Lung 1999;177:161-7.
- Lammi L, Kinnula V, Lähde S, et al. Propeptide levels of type III and type I procollagen in the serum and bronchoalveolar lavage fluid of patients with pulmonary sarcoidosis. Eur Respir J 1997;10:2725-30.
- Sharma OP. Markers of sarcoidosis activity. Chest 1986;90:471-3.
- Costabel U, du Bois R, Eklund A, et al. Consensus conference: activity of sarcoidosis. Eur Respir J 1994;7:624-7.
- Lawrence EC, Brouseau KP, Berger MB, Kurman CC, Marcon L, Nelson DL. Elevated concentrations of soluble interleukin-2 receptors in serum samples and bronchoalveolar lavage fluids in active sarcoidosis. Am Rev Respir Dis 1988;137:759-64.
- Tsutsumi T, Nagai S, Imai K, Setoyama Y, Uchiyama T, Izumi T. Soluble interleukin-2 receptor in blood from patients with sarcoidosis and idiopathic pulmonary fibrosis. Sarcoidosis 1994;11:102-9.
- Vink A, Uyttenhove C, Wauters P, Van Snick J. Accessory factors involved in murine T cell activation. Distinct roles of interleukin 6, interleukin 1 and tumor necrosis factor. Eur J Immunol 1990;20:1-6.
- Kumar A, Moreau JL, Gibert M, Thèze J. Internalization of interleukin 2 (IL-2) by high affi nity IL-2 receptors is required for the growth of IL-2-dependent T cell lines. J Immunol 1987;139:3680-4.
- Yamada T. Serum amyloid A (SAA): a concise review of biology, assay methods and clinical usefulness. Clin Chem Lab Med 1999;37:381-8.
- Bateman E, Turner-Warwick M, Adelman-Grill BC. Immunohistochemical study of collagen types in human foetal lung fibrotic lung disease. Thorax 1981;36:645-53.
- Risteli J, Risteli L. Analysing connective tissue metabolites in human serum. Biochemical, physiological and methodological aspects. J Hepatol 1995;22(2 Suppl):77-81.
- Anttinen H, Terho EO, Järvensivu PM, Savolainen E-R. Elevated serum galactosylhydroxylysyl glucosyltransferase, a collagen synthesis marker, in fibrosing lung diseases. Clin Chim Acta 1985;3:3-8.
- Anttinen H, Terho EO, Myllylä R, Savolainen ER. Two serum markers of collagen biosynthesis as possible indicators of irreversible pulmonary impairment in farmers lung. Am Rev Respir Dis 1986;133:88-93.
- Poole A, Myllylä R, Davies BH. Activities of enzymes of collagen biosynthesis and levels of type III procollagen peptide in serum of patients with sarcoidosis. Life Sci 1989;45:319-26.
- Luisetti M, Bulgheroni A, Baccella L, Pasturenzi L, Aprile C. Elevated serum procollagen III aminopeptide levels in sarcoidosis. Chest 1990;98:1414-20.
- Pohl WR, Thompson AB, Köhn H, et al. Serum procollagen III peptide levels in subjects with sarcoidosis. A 5-year follow-up study. Am Rev Respir Dis 1992;145:412-7.
- Hirasawa Y, Kohno N, Yokoyama A, Inoue Y, Abe M, Hiwada K. KL-6, a human MUC1 mucin, is chemotactic for human fibroblasts. Am J Respir Cell Mol Biol 1997;17:501-7.
- Kohno N, Kyoizumi S, Awaya Y, Fukuhara H, Yamakido M, Akiyama M. New serum indicator of interstitial pneumonitis activity. Sialylated carbohydrate antigen KL-6. Chest 1989;96:68-73.
- Doishita S, Inokuma S, Asashima H, et al. Serum KL-6 level as an indicator of active or inactive interstitial pneumonitis associated with connective tissue diseases. Intern Med 2011;50:2889-92.
- Hamada H, Kohno N, Akiyama M, Hiwada K. Monitoring of serum KL-6 antigen in a patient with radiation pneumonia. Chest 1992;101:858-60.
- Kobayashi J, Kitamura S. Serum KL-6 for the evaluation of active pneumonitis in pulmonary sarcoidosis. Chest 1996;109:1276-82.
- Hermans C, Bernard A. Lung epithelium-specific proteins: characteristics and potential applications as markers. Am J Respir Crit Care Med 1999;159:646-78.
- Honda Y, Kuroki Y, Matsuura E, et al. Pulmonary surfactant protein D in sera and bronchoalveolar lavage fluids. Am J Respir Crit Care Med 1995;152:1860-6.
- Hermans C, Petrek M, Kolek V, et al. Serum Clara cell protein (CC16), a marker of the integrity of the air-blood barrier in sarcoidosis. Eur Respir J 2001;18:507-14.
- Bernard A, Dumont X, Roels H, et al. The molecular mass and concentrations of protein 1 or Clara cell protein in biological fluids: a reappraisal. Clin Chim Acta 1993;223:189-91.
- Ohnishi H, Yokoyama A, Kondo K, et al. Comparative study of KL-6, surfactant protein-A, surfactant protein-D, and monocyte chemoattractant protein-1 as serum markers for interstitial lung diseases. Am J Respir Crit Care Med 2002;165:378-81.
- Greene KE, King Jr TE, Kuroki Y, et al. Serum surfactant proteins-A and -D as biomarkers in idiopathic pulmonary fibrosis. Eur Respir J 2002;19:439-46.
- Ina Y, Takada K, Sato T, Yamamoto M, Noda M, Morishita M. Soluble interleukin 2 receptors in patients with sarcoidosis. Possible origin. Chest 1992;102:1128-33.
- Prior C, Barbee RA, Evans PM, et al. Lavage versus serum measurements of lysozyme, angiotensin converting enzyme and other inflammatory markers in pulmonary sarcoidosis. Eur Respir J 1990;3:1146-54.
- Tsutsumi T, Nagai S, Imai K, Setoyama Y, Uchiyama T, Izumi T. Soluble interleukin-2 receptor in blood from patients with sarcoidosis and idiopathic pulmonary fibrosis. Sarcoidosis 1994;11:102-9.
- Ziegenhagen MW, Benner UK, Zissel G, Zabel P, Schlaak M, Müller-Quernheim J. Sarcoidosis: TNF-alpha release from alveolar macrophages and serum level of sIL-2R are prognostic markers. Am J Respir Crit Care Med 1997;156:1586-92.
- Westall GP, Stirling RG, Cullinan P, et al. Interstitial Lung Disease. 4th ed. Hamilton: BC Decker; 2003. p. 332-86.
- Low RB, Cutroneo KR, Davis GS, Giancola MS. Lavage type III procollagen N-terminal peptides in human pulmonary fibrosis and sarcoidosis. Lab Invest 1983;48:755-9.
- Milman N, Kristensen MS, Bentsen K, Grode G, Fredriksen J. Hyaluronan and procollagen type III aminoterminal peptide in serum and bronchoalveolar ravage fluid in patients with pulmonary sarcoidosis. Sarcoidosis 1995;12:38-41.
- Lesur O, Bernard A, Arsalane K, et al. Clara cell protein (CC-16) induces a phospholipase A2-mediated inhibition of fibroblast migration in vitro. Am J Respir Crit Care Med 1995;152:290-7.
